Εισαγωγή:
Πρόκειται για ένα ανθρώπινο μονοκλωνικό αντίσωμα (HuMAb) ανοσοσφαιρίνης G4 (IgG4) το οποίο προσδένεται στον υποδοχέα της πρωτεΐνης προγραμματισμένου θανάτου‑1 (PD‑1) και αναστέλλει την αλληλεπίδραση με τους συνδέτες PD‑L1 και PD‑L2. Ο υποδοχέας PD‑1 είναι ένας αρνητικός ρυθμιστής της δραστηριότητας των T‑κυττάρων, ο οποίος έχει αποδειχθεί ότι συμμετέχει στον έλεγχο της ανοσολογικής απάντησης των T‑κυττάρων. Η σύνδεση του PD‑1 με τους συνδέτες PD‑L1 και PD‑L2, οι οποίοι εκφράζονται σε αντιγονοπαρουσιαστικά κύτταρα και μπορεί να εκφράζονται από όγκους ή άλλα κύτταρα στο μικροπεριβάλλον του όγκου, οδηγεί σε αναστολή του πολλαπλασιασμού των T‑κυττάρων, καθώς και της απελευθέρωσης κυτοκινών. Με αυτό τον τρόπο ενισχύεται η απάντηση των T‑κυττάρων, συμπεριλαμβανομένης της αντινεοπλασματικής απάντησης, μέσω αναστολής της πρόσδεσης της PD‑1 στους συνδέτες PD‑L1 και PD‑L2.
Δοσολογία:
-
Η συνιστώμενη δόση του KEYTRUDA ως μονοθεραπεία είναι είτε 200 mg κάθε 3 εβδομάδες, είτε 400 mg κάθε 6 εβδομάδες, χορηγούμενη ως ενδοφλέβια έγχυση σε 30 λεπτά.
-
Η συνιστώμενη δόση του KEYTRUDA ως μέρος θεραπείας συνδυασμού είναι 200 mg κάθε 3 εβδομάδες, χορηγούμενη ως ενδοφλέβια έγχυση σε 30 λεπτά.
Ενδείξεις:
Το Pembrolizumab ενδείκνυται σε ενήλικες με:
Μελάνωμα
1. Προχωρημένο (ανεξαίρετο ή μεταστατικό) μελανώμα σε ενήλικες.
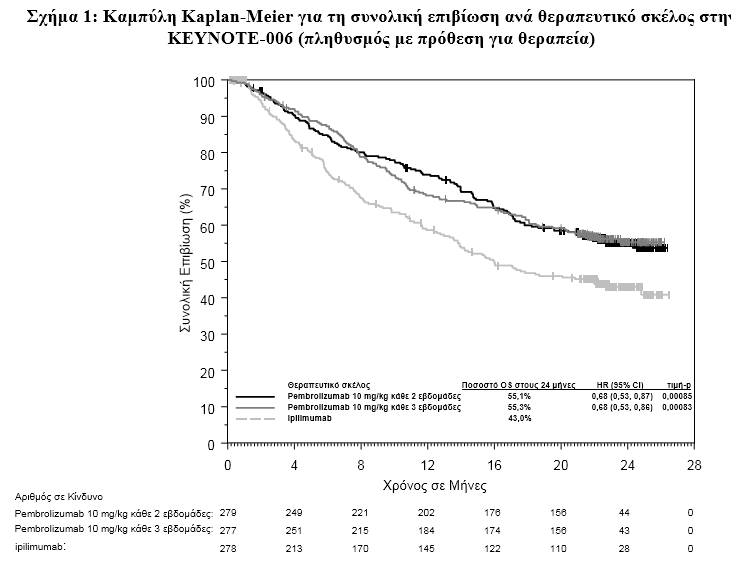
Η ασφάλεια και η αποτελεσματικότητα του pembrolizumab ερευνήθηκαν σε μία φάσης 3 μελέτη, την KEYNOTE-006 , σε ασθενείς που δεν είχαν λάβει προηγούμενα Ipilimumab. H σύγκριση έγινε (1:1:1) μεταξύ pembrolizumab 10 mg/kg κάθε 2 (n=279) ή 3 εβδομάδες (n=277) ή ipilimumab 3 mg/kg κάθε 3 εβδομάδες (n=278). Σε παρουσία BRAFV600E μετάλλαξης δεν απαιτούνταν να έχουν λάβει προηγούμενη θεραπεία με αναστολέα BRAF.
Επιδημιολογικά χαρακτηριστικά: 60 % ήταν άνδρες, το 44 % ήταν ≥ 65 ετών (η διάμεση ηλικία ήταν 62 έτη), 98 % ήταν λευκοί, 65% ήταν σε στάδιο Μ1c, 9 % είχε ιστορικό μεταστάσεων στον εγκέφαλο, 66 % δεν είχε λάβει καμία προηγούμενη θεραπεία, 34 % είχε λάβει μία προηγούμενη θεραπεία, 35% ήταν ECOG 1, 32 % είχε αυξημένη LDH. Μεταλλάξεις BRAF είχαν 36 % των ασθενών/ από αυτούς το 46% είχε λάβει προηγουμένως θεραπεία με έναν αναστολέα BRAF.
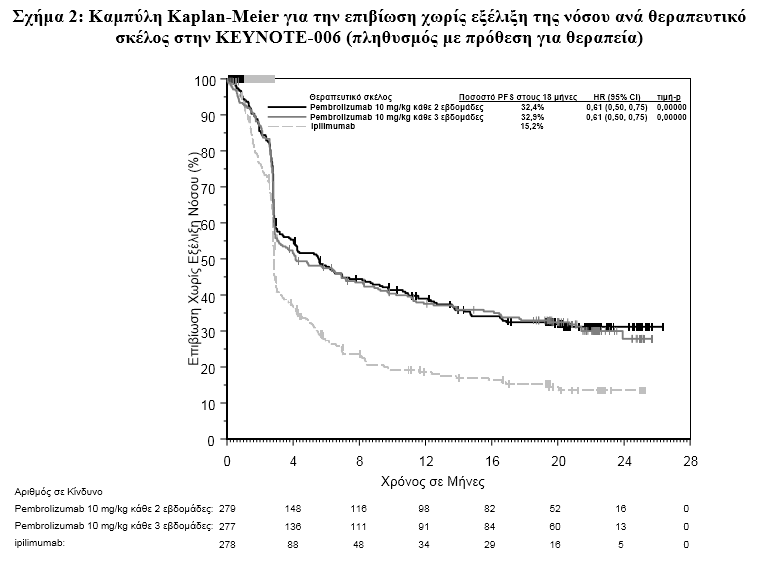
Τα πρωταρχικά σημεία έκβασης της αποτελεσματικότητας ήταν η επιβίωση χωρίς εξέλιξη της νόσου (PFS, όπως εκτιμήθηκε μέσω της ανασκόπησης της Ολοκληρωμένης Ακτινολογικής και Ογκολογικής Αξιολόγησης [IRO], χρησιμοποιώντας τα Κριτήρια Αξιολόγησης της Ανταπόκρισης για Συμπαγείς Όγκους [RECIST], έκδοση 1.1) και η συνολική επιβίωση (OS). Τα δευτερεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν το συνολικό ποσοστό ανταπόκρισης (ORR) και η διάρκεια της ανταπόκρισης (Πίνακας 1).
Πίνακας 1: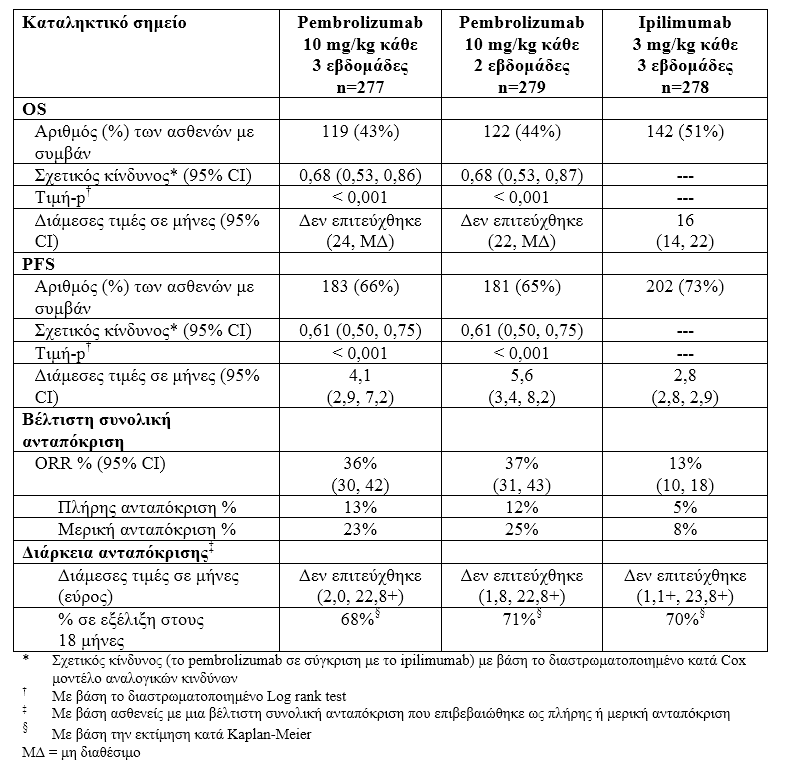
Η ασφάλεια και η αποτελεσματικότητα του pembrolizumab ερευνήθηκαν επίσης στην ΚΕΥΝΟΤΕ-002, σε ασθενείς που προηγουμένως είχαν λάβει θεραπεία ipilimumab και εάν η μεταλλαγή BRAFV600 ήταν θετική, με έναν αναστολέα BRAF ή ΜΕΚ.
Οι ασθενείς τυχαιοποιήθηκαν (1:1:1) να λάβουν το pembrolizumab σε μια δόση των 2 (n=180) ή των 10 mg/kg (n=181) κάθε 3 εβδομάδες ή χημειοθεραπεία (n=179, συμπεριλαμβανομένης της δακαρβαζίνης, της τεμοζολομίδης, της καρβοπλατίνης, της πακλιταξέλης ή της καρβοπλατίνης+ πακλιταξέλης).
Οι ασθενείς που λάμβαναν χημειοθεραπεία και οι οποίοι παρουσίασαν ανεξάρτητα επιβεβαιωμένη εξέλιξη της νόσου μετά την πρώτη προγραμματισμένη αξιολόγηση της νόσου, μπόρεσαν να κάνουν μετάβαση στο άλλο θεραπευτικό σκέλος (crossover) και να λάβουν 2 mg/kg ή 10 mg/kg pembrolizumab κάθε 3 εβδομάδες κατά τρόπο διπλά τυφλό.
Επιδημιολογικά χαρακτηριστικά: 61 % ήταν άνδρες, 43 % ήταν ≥ 65 ετών (η διάμεση ηλικία ήταν 62 έτη), 98 % ήταν λευκοί, 82% σε στάδιο Μ1c, 73 % είχε τουλάχιστον δύο και 32 % των ασθενών είχε τρεις ή περισσότερες προηγούμενες συστηματικές θεραπείες για προχωρημένο μελάνωμα, 45% ήταν ECOG 1, 40 % είχε αυξημένη LDH και 23 % είχε έναν BRAF μεταλλαγμένο όγκο.
Τα πρωταρχικά σημεία έκβασης της αποτελεσματικότητας ήταν η PFS, όπως εκτιμήθηκε με IRO, χρησιμοποιώντας τα Κριτήρια RECIST έκδοση 1.1 και η OS. Τα δευτερεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν το ORR και η διάρκεια της ανταπόκρισης. Και τα δύο θεραπευτικά σκέλη του pembrolizumab υπερείχαν ως προς τη χημειοθεραπεία, όσον αφορά την PFS και δεν υπήρξε καμία διαφορά μεταξύ των δόσεων του pembrolizumab. Δεν υπήρξε στατιστικά σημαντική διαφορά μεταξύ του pembrolizumab και της χημειοθεραπείας στην τελική ανάλυση της OS που δεν προσαρμόστηκε για ενδεχόμενες συγκεχυμένες επιδράσεις της μετάβασης. Από τους ασθενείς που τυχαιοποιήθηκαν στο σκέλος της χημειοθεραπείας, το 55 % μετέβησαν στο άλλο θεραπευτικό σκέλος (crossed over) και επακόλουθα έλαβαν την αγωγή pembrolizumab.
Πίνακας 2: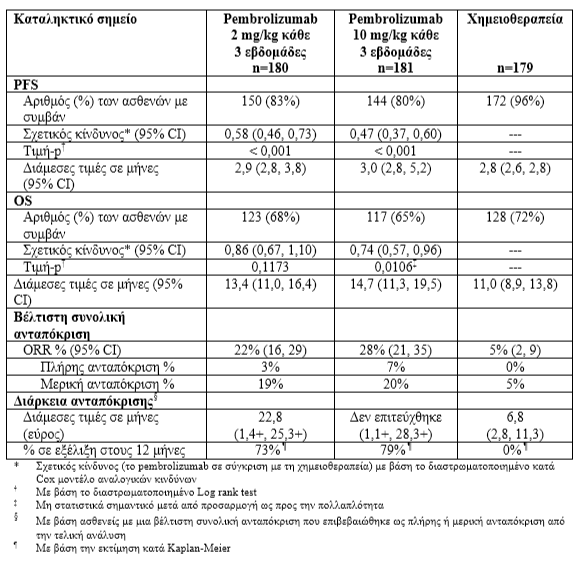
Επιπλέον, η ασφάλεια και η αποτελεσματικότητα του pembrolizumab σε ασθενείς με προχωρημένο μελάνωμα ερευνήθηκαν σε μία μη-ελεγχόμενη, ανοιχτού σχεδιασμού μελέτη, την KEYNOTE-001. Η αποτελεσματικότητα αξιολογήθηκε σε 276 ασθενείς από δύο καθορισμένες κοόρτεις, η μία εκ των οποίων περιελάμβανε ασθενείς που είχαν λάβει προηγούμενη θεραπεία με ipilimumab (και εάν η μεταλλαγή BRAFV600 ήταν θετική, με έναν αναστολέα BRAF ή MEK) και η άλλη περιελάμβανε ασθενείς που δεν είχαν λάβει προηγούμενη θεραπεία με ipilimumab. Οι ασθενείς επιλέχθηκαν τυχαία να λάβουν το pembrolizumab σε μια δόση των 2 mg/kg κάθε 3 εβδομάδες ή 10 mg/kg κάθε 3 εβδομάδες.
Από τους 89 ασθενείς που λάμβαναν 2 mg/kg pembrolizumab και οι οποίοι είχαν προηγουμένως λάβει θεραπεία με ipilimumab, 53 % ήταν άνδρες, 33 % ήταν ≥ 65 ετών ( διάμεση ηλικία ήταν 59 έτη), όλοι οι ασθενείς εκτός από δύο ήταν λευκοί, 84% ήταν σε στάδιο Μ1c , 8 % είχε ιστορικό μεταστάσεων στον εγκέφαλο, 75% είχε τουλάχιστον δύο και 35 % των ασθενών είχε τρεις ή περισσότερες προηγούμενες συστηματικές θεραπείες για προχωρημένο μελάνωμα, μεταλλάξεις BRAF: 13 % του πληθυσμού της μελέτης (όλοι οι ασθενείς με BRAF μεταλλαγμένους όγκους είχαν προηγουμένως λάβει θεραπεία με έναν αναστολέα BRAF).
Από τους 51 ασθενείς που λάμβαναν 2 mg/kg pembrolizumab και οι οποίοι δεν είχαν προηγουμένως λάβει θεραπεία με ipilimumab, 63 % ήταν άνδρες, 35 % ήταν ≥ 65 ετών ( διάμεση ηλικία ήταν 60 έτη), όλοι οι ασθενείς εκτός από έναν ήταν λευκοί, 63%ήταν σε στάδιο Μ1c , μόνο 2% των ασθενών είχε ιστορικό μεταστάσεων στον εγκέφαλο, 45% δεν είχε λάβει προηγούμενες θεραπείες για προχωρημένο μελάνωμα, BRAF μεταλλάξεις: 39 %(από αυτούς 50 % είχαν προηγουμένως λάβει θεραπεία με έναν αναστολέα BRAF).
Τα πρωταρχικά σημεία έκβασης της αποτελεσματικότητας ήταν το συνολικό ποσοστό ανταπόκρισης (ORR), όπως εκτιμήθηκε από ανεξάρτητη ανασκόπηση χρησιμοποιώντας τα κριτήρια RECIST 1.1. Τα δευτερεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν το ποσοστό ελέγχου της νόσου (DCR, συμπεριλαμβανομένης της πλήρους ανταπόκρισης, της μερικής ανταπόκρισης και της σταθερής νόσου), η διάρκεια της ανταπόκρισης, η επιβίωση χωρίς εξέλιξη της νόσου (PFS) και η συνολική επιβίωση (OS). Η ανταπόκριση του όγκου αξιολογούνταν σε διαστήματα των 12-εβδομάδων.
Τα αποτελέσματα σε ασθενείς που είχαν λάβει προηγούμενη θεραπεία με ipilimumab (n=84) και σε ασθενείς που δεν είχαν λάβει προηγούμενη θεραπεία με ipilimumab (n=52) και έλαβαν 10 mg/kg pembrolizumab κάθε 3 εβδομάδες ήταν παρόμοια με εκείνα που παρατηρήθηκαν σε ασθενείς που έλαβαν 2 mg/kg pembrolizumab κάθε 3 εβδομάδες.
Πίνακας 3: Δεδομένα αποτελεσματικότητας στην KEYNOTE-001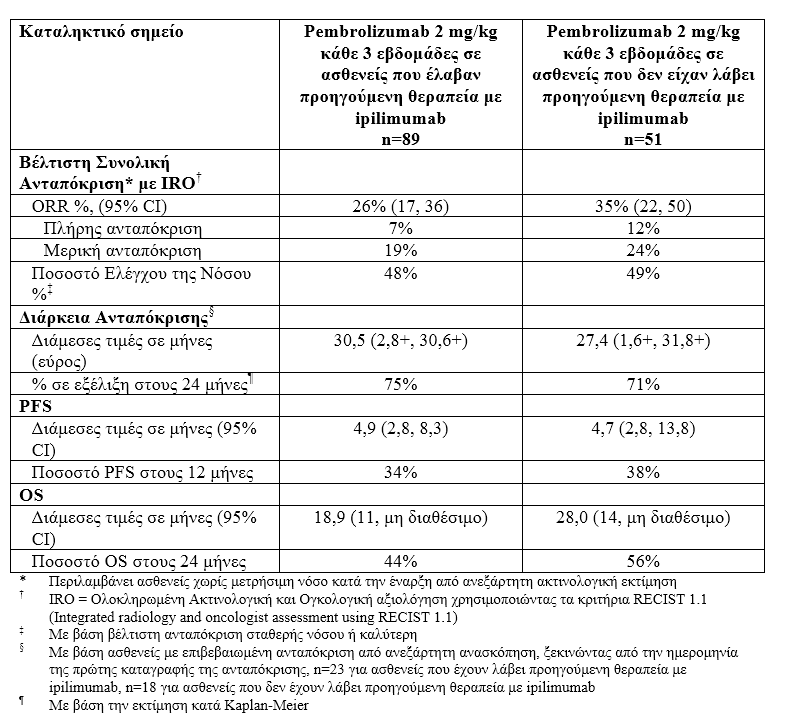
Και στις 3 μελέτες για το προχωρημένο ή μεταστατικό μελάνωμα:
-Σε κλινικά σταθερούς ασθενείς με αρχικές ενδείξεις εξέλιξης της νόσου επιτράπηκε να παραμείνουν στη θεραπεία μέχρι να επιβεβαιωθεί η εξέλιξη της νόσου
- Η αξιολόγηση της κατάστασης του όγκου πραγματοποιούνταν στις 12 εβδομάδες, κατόπιν κάθε 6 εβδομάδες μέχρι την εβδομάδα 48 και στη συνέχεια κάθε 12 εβδομάδες.
-Οι ασθενείς έλαβαν το Pembrolizumab μέχρι την εξέλιξη της νόσου ή μη αποδεκτής τοξικότητας.
2. Ως επικουρική θεραπεία ενηλίκων με μελάνωμα Σταδίου III και με συμμετοχή των λεμφαδένων, οι οποίοι έχουν υποβληθεί σε πλήρη εξαίρεση
Η αποτελεσματικότητα του pembrolizumab αξιολογήθηκε σε μία φάσης ΙΙΙ μελέτη, την KEYNOTE-054, σε σύγκριση με εικονικό φάρμακο, σε ασθενείς με μελάνωμα σταδίου IIIA (> 1 mm μετάσταση λεμφαδένα), ΙΙΙΒ ή IIIC, το οποίο είχε εξαιρεθεί πλήρως. Συνολικά, 1.019 ενήλικες ασθενείς τυχαιοποιήθηκαν (1:1) για να λάβουν pembrolizumab 200 mg κάθε τρεις εβδομάδες (n=514) ή εικονικό φάρμακο (n=505), για έως και ένα χρόνο μέχρι την υποτροπή της νόσου ή την εμφάνιση μη αποδεκτής τοξικότητας.
Η διαστρωμάτωση έγινε με βάση τη σταδιοποίηση [7η έκδοση της AJCC] (IIIAvs. IIIBvs. IIIC 1-3 θετικοί λεμφαδένες vs. IIIC ≥ 4 θετικοί λεμφαδένες) και την γεωγραφική περιοχή (Βόρεια Αμερική, Ευρωπαϊκές χώρες, Αυστραλία και άλλες χώρες όπως ορίστηκαν). Οι ασθενείς έπρεπε να έχουν υποβληθεί σε εκτομή λεμφαδένων +/- σε ακτινοθεραπεία (εφόσον ενδεικνυόταν) εντός διαστήματος 13 εβδομάδων πριν την έναρξη της θεραπείας. Δεν συμπεριλήφθηκαν ασθενείς με μελάνωμα των βλεννογόνων ή των οφθαλμών ούτε αυτοί που είχαν λάβει προηγούμενη θεραπεία για τη νόσο τους εκτός από χειρουργική επέμβαση ή ιντερφερόνη για συμπαγή πρωτοπαθή μελανώματα χωρίς ενδείξεις συμμετοχής λεμφαδένων, όπως και ασθενείς που είχαν αυτοάνοσα νοσήματα ή συννοσηρότητα που απαιτούσε ανοσοκατασταλτική θεραπεία.
Οι ασθενείς υποβάλλονταν σε απεικονιστικό έλεγχο κάθε 12 εβδομάδες μετά την πρώτη δόση του pembrolizumab για τα πρώτα δύο χρόνια, κατόπιν κάθε 6 μήνες από τον 3 ο έως τον 5ο χρόνο και στη συνέχεια ετησίως.
Επιδημιολογικά χαρακτηριστικά: διάμεση ηλικία 54 έτη (το 25 % είχε ηλικία 65 έτη ή μεγαλύτερη), 62 % ήταν άνδρες με ECOG 0 (94 %) και 1 (6 %), 16% ήταν σταδίου ΙΙΙΑ, 46 % ήταν σταδίου IIIB, 18 % ήταν σταδίου IIIC (1-3 θετικοί λεμφαδένες) και 20 % ήταν σταδίου IIIC (≥ 4 θετικοί λεμφαδένες), 44 % δεν έφερε τη μετάλλαξη BRAF (BRAF: wild type) και 50% είχαν τη μετάλλαξη.
Η έκφραση του PD-L1 ελέγχθηκε αναδρομικά μέσω ανοσοϊστοχημικού ελέγχου με το 22C3 αντίσωμα του αντι-PD-L1. 84 % των ασθενών είχε θετική έκφραση του PD-L1 στο μελάνωμα (έκφραση του PD-L1 σε ≥ 1 % των καρκινικών κυττάρων και των σχετιζόμενων με τον όγκο ανοσοποιητικών κυττάρων, σε σχέση με όλα τα βιώσιμα καρκινικά κύτταρα). Το ίδιο σύστημα βαθμολόγησης χρησιμοποιούνταν στο μεταστατικό μελάνωμα (MELscore).
Τα πρωτεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν η εκτιμώμενη από τον ερευνητή επιβίωση χωρίς υποτροπή της νόσου (RFS) στο σύνολο του πληθυσμού και στον πληθυσμό με όγκους που έχουν θετική έκφραση του PD-L1, όπου το RFS ορίστηκε ως το χρονικό διάστημα μεταξύ της ημερομηνίας τυχαιοποίησης και της ημερομηνίας πρώτης υποτροπής (τοπική, περιοχική ή απομακρυσμένη μετάσταση) ή του θανάτου, οποιοδήποτε συμβεί πρώτο.
Η δοκιμή επέδειξε μια στατιστικά σημαντική βελτίωση του RFS σε ασθενείς που τυχαιοποιήθηκαν στο σκέλος του pembrolizumab σε σύγκριση με το εικονικό φάρμακο στην προκαθορισμένη ενδιάμεση ανάλυση.
Πίνακας 4: Δεδομένα αποτελεσματικότητας στην KEYNOTE-054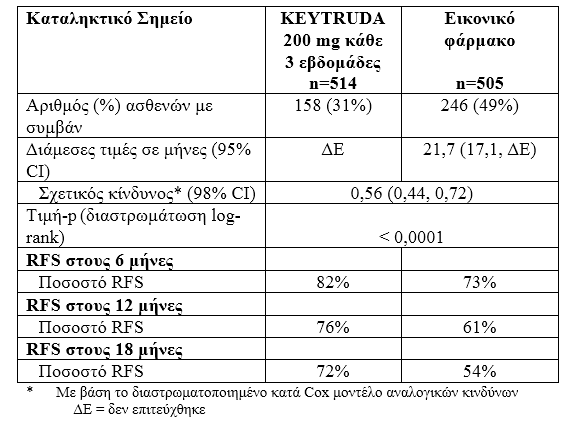
Στην KEYNOTE-054 διεξάχθηκε μια ανάλυση υποομάδας της RFS σύμφωνα με την 8η έκδοση της AJCC μετά την αναφορά των αποτελεσμάτων RFS της μελέτης. Αποδείχθηκε μια στατιστικά σημαντική βελτίωση της RFS σε ασθενείς που τυχαιοποιήθηκαν στο σκέλος του pembrolizumab σε σύγκριση με το εικονικό φάρμακο, στο σύνολο του πληθυσμού με μελάνωμα σταδίου ΙΙΙ, το οποίο είχε εξαιρεθεί σύμφωνα με την 7η έκδοση της AJCC. Το μελάνωμα σταδίου IIIA σύμφωνα με την 8 η έκδοση της AJCC, αναγνωρίζει έναν πληθυσμό ασθενών με καλύτερη πρόγνωση σε σύγκριση με αυτόν του σταδίου ΙΙΙΑ σύμφωνα με την 7 η έκδοση της AJCC. Σύμφωνα με την κατάταξη της 8ης έκδοσης της AJCC, ένα σύνολο 82 ατόμων ταξινομήθηκε ως σταδίου IIIA, οι 42 στο σκέλος του pembrolizumab και οι 40 στο σκέλος του εικονικού φαρμάκου, με συνολικά 13 RFS συμβάματα, εκ των οποίων τα 6 ήταν στο σκέλος του pembrolizumab και τα 7 στο σκέλος του εικονικού φαρμάκου. Yπάρχουν περιορισμένα δεδομένα σε άτομα σταδίου ΙΙΙΑ σύμφωνα με την 8η έκδοση της AJCC κατά την χρονική στιγμή αυτής της RFS ανάλυσης.
Αν και η ανάλυση σε ασθενείς με όγκους που έχουν θετική έκφραση του PD-L1 ήταν ένα συνπρωτεύον καταληκτικό σημείο, διεξάχθηκαν προκαθορισμένες αναλύσεις υποομάδων σε ασθενείς, των οποίων οι όγκοι είχαν αρνητική έκφραση του PD-L1, θετική ή αρνητική μετάλλαξη BRAF.
Πίνακας 5: Δεδομένα αποτελεσματικότητας με βάση την έκφραση του PD-L1 και την μετάλλαξη BRAF στην KEYNOTE-054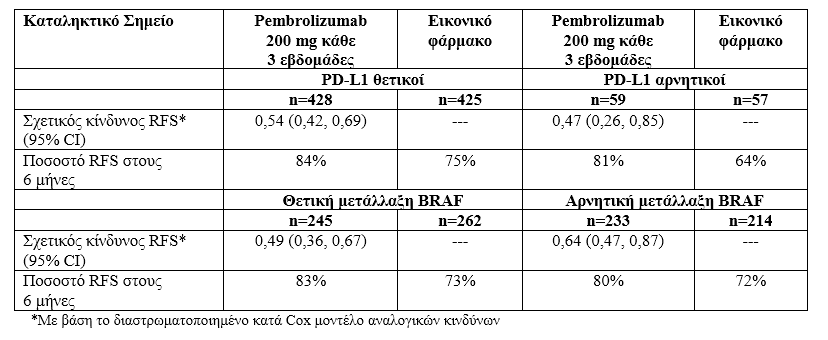
Καρκίνος Πνεύμονα
1. Ως αγωγή πρώτης γραμμής του μεταστατικού μη μικροκυτταρικού καρκίνου του πνεύμονα (NSCLC) σε ενήλικες, των οποίων οι όγκοι εκφράζουν το PD-L1 με βαθμολογία αναλογίας όγκου (TPS) ≥ 50 %, χωρίς EGFR ή ALK θετικές μεταλλάξεις όγκου.
Η ασφάλεια και η αποτελεσματικότητα του pembrolizumab ερευνήθηκαν στην φάσης ΙΙΙ μελέτη ΚΕΥΝΟΤΕ-024, σε ασθενείς που δεν είχαν λάβει προηγούμενη θεραπεία. Οι ασθενείς είχαν έκφραση του PD-L1 με βαθμολογία αναλογίας όγκου (TPS) ≥ 50 % με βάση τον ανοσοϊστοχημικό (IHC) έλεγχο με το 22C3 pharmDx TMKit του PD-L1.
Οι ασθενείς τυχαιοποιήθηκαν (1:1) να λάβουν το pembrolizumab σε μια δόση των 200 mg κάθε 3 εβδομάδες (n=154) ή χημειοθεραπεία επιλογής του ερευνητή που περιείχε πλατίνα (n=151, συμπεριλαμβανομένων των πεμετρεξίδη+καρβοπλατίνη, πεμετρεξίδη+σισπλατίνη, γεμσιταβίνη+σισπλατίνη, γεμσιταβίνη+καρβοπλατίνη ή πακλιταξέλη+καρβοπλατίνη. Ασθενείς μη πλακώδους ιστολογικού τύπου θα μπορούσαν να λάβουν θεραπεία συντήρησης με πεμετρεξίδη).
Οι ασθενείς έλαβαν pembrolizumab μέχρι την εμφάνιση μη αποδεκτής τοξικότητας ή μέχρι την εξέλιξη της νόσου. Η αγωγή θα μπορούσε να συνεχιστεί και πέρα από την εξέλιξη της νόσου, εάν ο ασθενής ήταν κλινικά σταθερός και θεωρούνταν από τον ερευνητή ότι προκύπτει κλινικό όφελος. Οι ασθενείς χωρίς εξέλιξη της νόσου θα μπορούσαν να λάβουν την αγωγή για έως και 24 μήνες.
Βασικά κριτήρια αποκλεισμού: ασθενείς με EGFR ή ALK γονιδιωματικές μεταλλάξεις όγκου, με αυτοάνοση νόσο που απαιτούσε συστηματική θεραπεία μέσα στα 2 χρόνια της αγωγής, μία ιατρική κατάσταση που απαιτούσε ανοσοκαταστολή ή εκείνους που είχαν λάβει περισσότερο από 30 Gy ακτινοβολίας στον θώρακα κατά τις προηγούμενες 26 εβδομάδες. Η απεικονιστική παρακολούθηση γινόταν κάθε 9 εβδομάδες. Οι ασθενείς που ελάμβαναν χημειοθεραπεία είχαν τη δυνατότητα να μεταβούν στην άλλη ομάδα (crossover) και να λάβουν το pembrolizumab επί προόδου νόσου.
Επιδημιολογικά χαρακτηριστικά: διάμεση ηλικία 65 έτη (το 54 % είχε ηλικία 65 έτη ή μεγαλύτερη), 61 % άνδρες, 82 % ήταν Λευκοί, 15 % Ασιατικής καταγωγής και 35 % και 65 % με βαθμολογία κατάστασης λειτουργικότητας κατά ECOG 0 και 1 αντίστοιχα- Πλακώδης ιστολογικός τύπος (18 %)-Μη πλακώδης ιστολογικός τύπος (82 %), σταδίου Μ1 (99 %) και με εγκεφαλικές μεταστάσεις (9 %).
Τα πρωτεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν η PFS όπως εκτιμήθηκε μέσω τυφλής, ανεξάρτητης, κεντρικής αξιολόγησης (BICR) χρησιμοποιώντας τα κριτήρια RECIST 1.1. Τα δευτερεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν η OS και το ORR (όπως εκτιμήθηκαν μέσω της BICR χρησιμοποιώντας τα κριτήρια RECIST 1.1). Ο πίνακας 12 συνοψίζει τα κύρια σημεία αποτελεσματικότητας για το σύνολο του πληθυσμού με πρόθεση για θεραπεία (ITT). Αναφέρονται τα αποτελέσματα της PFS και του ORR από μια ενδιάμεση ανάλυση για μια διάμεση περίοδο παρακολούθησης 11 μηνών. Αναφέρονται τα αποτελέσματα της OS από μια τελική ανάλυση για μια διάμεση περίοδο παρακολούθησης 25 μηνών.
Πίνακας 6: Δεδομένα αποτελεσματικότητας στην KEYNOTE-024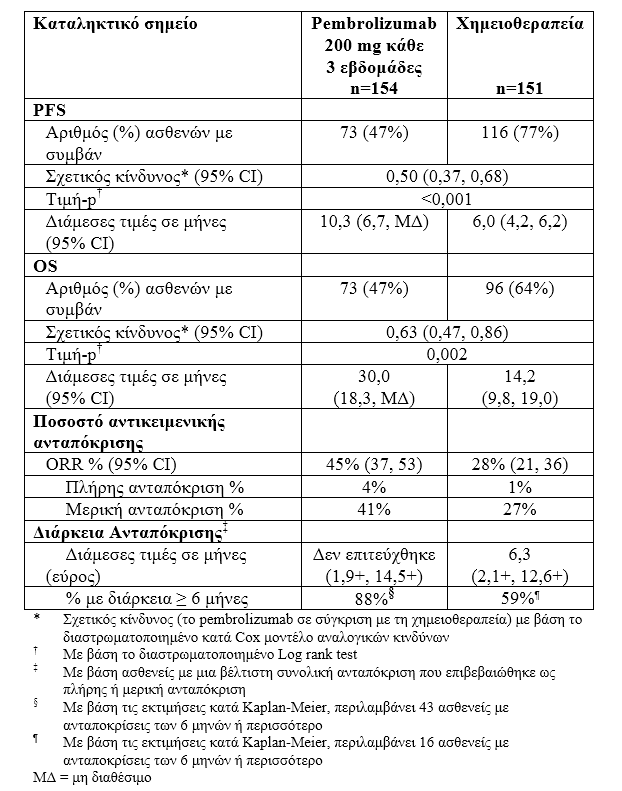
- Σε μια ανάλυση υποομάδας, παρατηρήθηκε μειωμένο όφελος επιβίωσης του pembrolizumab σε σύγκριση με τη χημειοθεραπεία σε μικρό αριθμό ασθενών που δεν υπήρξαν ποτέ καπνιστές. Ωστόσο, λόγω του μικρού αριθμού των ασθενών, δεν μπορούν να εξαχθούν οριστικά συμπεράσματα από αυτά τα δεδομένα.
Η ασφάλεια και η αποτελεσματικότητα του pembrolizumab ερευνήθηκαν επίσης στην KEYNOTE042, σε ασθενείς με τοπικά προχωρημένο ή μεταστατικό NSCLC που δεν είχα λάβει προηγούμενη θεραπεία. Ο σχεδιασμός της μελέτης ήταν παρόμοιος με εκείνον της KEYNOTE-024, με την εξαίρεση ότι οι ασθενείς είχαν 1% με βάση τον ανοσοϊστοχημικό (IHC) έλεγχο με το 22C3³έκφραση του PD-L1 με TPS pharmDx TM Kit του PD-L1. Οι ασθενείς τυχαιοποιήθηκαν (1:1) να λάβουν το pembrolizumab στη δόση των 200 mg κάθε 3 εβδομάδες (n=637) ή χημειοθεραπεία επιλογής του ερευνητή που περιείχε πλατίνα (n=637), συμπεριλαμβανομένων των πεμετρεξίδη+καρβοπλατίνη ή πακλιταξέλη+καρβοπλατίνη[ ασθενείς με NSCLC μη πλακώδους ιστολογικού τύπου θα μπορούσαν να λάβουν θεραπεία συντήρησης με πεμετρεξίδη]. Η αξιολόγηση της κατάστασης του όγκου γινόταν κάθε 9 εβδομάδες για τις πρώτες 45 εβδομάδες και κατόπιν κάθε 12 εβδομάδες. Μεταξύ των 1.274 ασθενών στην KEYNOTE-042, 47 % είχαν όγκους που εξέφραζαν το PD-L1 με TPS≥ 50%.
Επιδημιολογικά χαρακτηριστικά: διάμεση ηλικία 63 έτη ( 45 % είχε ηλικία 65 έτη ή μεγαλύτερη), 69 % ήταν άνδρες, 63 % ήταν Λευκοί, 32 % ήταν Ασιατικής καταγωγής, 17 % Ισπανικής ή Λατινικής καταγωγή, 31 % και 69 % ECOG 0 και 1 αντίστοιχα, πλακώδης ιστολογικός τύπος (37 %) και μη πλακώδης ιστολογικός τύπος (63 %), σταδίου ΙΙΙΑ (0,8 %), σταδίου ΙΙΙΒ (9 %), σταδίου ΙV (90 %) και με εγκεφαλικές μεταστάσεις για τις οποίες έλαβαν αγωγή (6 %).
Τo πρωτεύον σημείo έκβασης της αποτελεσματικότητας ήταν η OS. Τα δευτερεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν η PFS και το ORR (όπως εκτιμήθηκαν μέσω της BICR χρησιμοποιώντας τα κριτήρια RECIST 1.1). Η μελέτη επέδειξε μία στατιστικά σημαντική βελτίωση στην OS σε ασθενείς των οποίων οι όγκοι εξέφραζαν το PD-L1 με TPS ≥ 1% και τυχαιοποιήθηκαν στη μονοθεραπεία με pembrolizumab συγκριτικά με τη χημειοθεραπεία (HR 0,82, 95% CI 0,71, 0,93 στην τελική ανάλυση) και σε ασθενείς, των οποίων οι όγκοι εξέφραζαν το PD-L1 με TPS ≥ 50% και τυχαιοποιήθηκαν στη μονοθεραπεία με pembrolizumab συγκριτικά με τη χημειοθεραπεία. Ο παρακάτω πίνακας συνοψίζει τα κύρια σημεία αποτελεσματικότητας για τον πληθυσμό με TPS ≥ 50% στην τελική ανάλυση που διεξάχθηκε σε μια διάμεση περίοδο παρακολούθησης 15,4 μηνών.
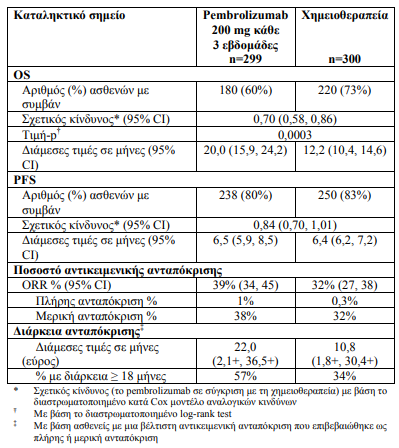
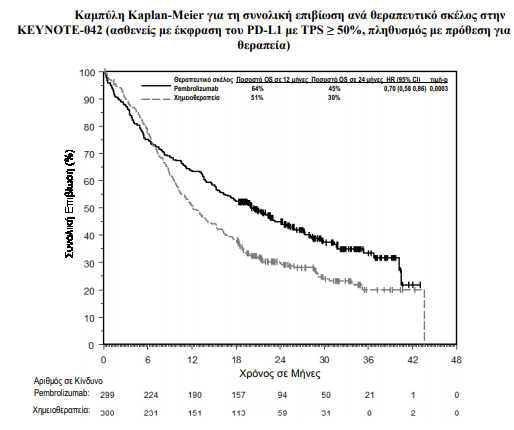
- Τα αποτελέσματα μιας post-hoc διερευνητικής ανάλυσης υποομάδας υπέδειξαν μια τάση μειωμένου οφέλους επιβίωσης του pembrolizumab σε σύγκριση με τη χημειοθεραπεία κατά τη διάρκεια τόσο των πρώτων 4 μηνών όσο και καθόλη τη διάρκεια της αγωγής σε ασθενείς που δεν ήταν ποτέ καπνιστές. Ωστόσο, λόγω της διερευνητικής φύσης της υποομάδας ανάλυσης, δεν μπορούν να εξαχθούν οριστικά συμπεράσματα.
2.Ως αγωγή του τοπικά προχωρημένου ή μεταστατικού μη μικροκυτταρικού καρκίνου του πνεύμονα (NSCLC) σε ενήλικες, των οποίων οι όγκοι εκφράζουν το PD-L1 με βαθμολογία αναλογίας όγκου TPS ≥ 1 % και οι οποίοι έχουν λάβει τουλάχιστον ένα προηγούμενο σχήμα χημειοθεραπείας. Aσθενείς με EGFR ή ALK θετικές μεταλλάξεις όγκου θα πρέπει επίσης να έχουν λάβει στοχεύουσα θεραπεία πριν λάβουν το KEYTRUDA.
Η ασφάλεια και η αποτελεσματικότητα του pembrolizumab ερευνήθηκαν στη μελέτη ΚΕΥΝΟΤΕ-010, σε ασθενείς με προχωρημένο ή μεταστατικό NSCLC που προηγουμένως είχαν λάβει αγωγή με χημειοθεραπεία που περιείχε πλατίνα. Οι ασθενείς είχαν έκφραση του PD-L1 με TPS ≥ 1 % με βάση τον ανοσοϊστοχημικό (IHC) έλεγχο με το 22C3 pharmDxTMKit του PD-L1. Ασθενείς με EGFR μετάλλαξη ή με ALK αναδιάταξη, προβλεπόταν να είχαν εμφανίσει εξέλιξη της νόσου υπό την εγκεκριμένη αγωγή για αυτές τις μεταλλάξεις πριν λάβουν το pembrolizumab.
Οι ασθενείς τυχαιοποιήθηκαν (1:1:1) να λάβουν pembrolizumab σε δόση των 2 (n=344) ή των 10 mg/kg (n=346) κάθε 3 εβδομάδες ή ντοσεταξέλη σε μια δόση των 75 mg/m2 κάθε 3 εβδομάδες (n=343) μέχρι την εξέλιξη της νόσου ή την εμφάνιση μη αποδεκτής τοξικότητας. Οι ασθενείς που αποκλείσθηκαν από τη μελέτη όπως και το follow-up των ασθενών ήταν όπως στη μελέτη KEYNOTE -024.
Επιδημιολογικά χαρακτηριστικά: διάμεση ηλικία 63 έτη (42 % είχε ηλικία 65 έτη ή μεγαλύτερη), 61 % άνδρες, 72 % Λευκοί, 21 % Ασιατικής καταγωγής, 34 % και 66 % με ECOG 0 και 1 αντίστοιχα, πλακώδης ιστολογικός τύπος (21 %), μη πλακώδης ιστολογικός τύπος (70 %), σταδίου Μ1 (91 %), με σταθεροποιημένες εγκεφαλικές μεταστάσεις (15 %) και η επίπτωση των μεταλλάξεων ήταν για το EGFR (8 %) ή το ALK (1 %). Η προηγούμενη αγωγή περιλάμβανε σχήμα πλατινούχου συνδυασμού (100 %), οι ασθενείς έλαβαν μία (69 %) ή δύο ή περισσότερες (29 %) γραμμές θεραπείας
Τα πρωτεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν η OS και η PFS όπως εκτιμήθηκαν μέσω τυφλής, ανεξάρτητης, κεντρικής αξιολόγησης (BICR) χρησιμοποιώντας τα κριτήρια RECIST 1.1. Τα δευτερεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν το ORR και η διάρκεια της ανταπόκρισης. Ο πίνακας 17 συνοψίζει τα κύρια σημεία αποτελεσματικότητας για το σύνολο του πληθυσμού (βαθμολογία αναλογίας όγκου [TPS] ≥ 1 %) και για τους ασθενείς με TPS³ 50% και το Σχήμα 11 δείχνει την καμπύλη Kaplan-Meier για την OS (TPS³ 1%), με βάση μια τελική ανάλυση με διάμεση περίοδο παρακολούθησης 42,6 μήνες
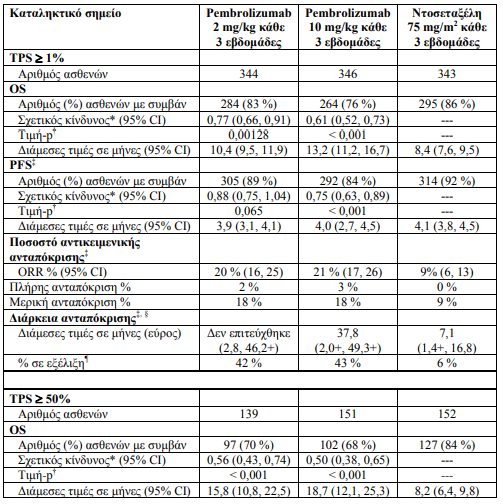
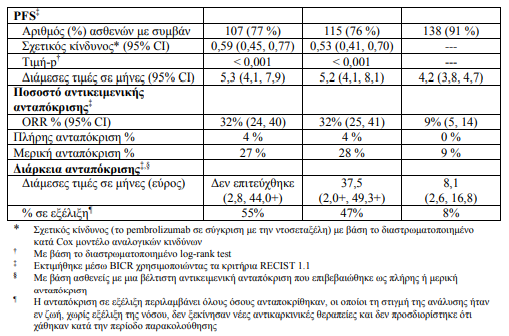
Τα αποτελέσματα ως προς την αποτελεσματικότητα ήταν παρόμοια για τα θεραπευτικά σκέλη του pembrolizumab 2 mg/kg και 10 mg/kg. Τα δεδομένα της αποτελεσματικότητας για την OS ήταν σταθερά ανεξάρτητα από την ηλικία του δείγματος του όγκου ( πρόσφατη βιοψία έναντι αρχειακού δείγματος).
- Σε αναλύσεις υποομάδων, παρατηρήθηκε μειωμένο όφελος επιβίωσης του pembrolizumab σε σύγκριση με την ντοσεταξέλη σε ασθενείς που δεν ήταν ποτέ καπνιστές ή σε ασθενείς με όγκους που έφεραν EGFR μεταλλάξεις ενεργοποίησης και οι οποίοι έλαβαν τουλάχιστον μία χημειοθεραπεία με βάση την πλατίνα και έναν αναστολέα της κινάσης της τυροσίνης. Ωστόσο, λόγω του μικρού αριθμού των ασθενών, δεν μπορούν να εξαχθούν οριστικά συμπεράσματα από αυτά τα δεδομένα
Η αποτελεσματικότητα και η ασφάλεια του pembrolizumab σε ασθενείς με όγκους που δεν εκφράζουν το PD-L1 δεν έχουν τεκμηριωθεί.
3. Σε συνδυασμό με χημειοθεραπεία με πεμετρεξίδη και πλατίνα, ως αγωγή πρώτης γραμμής του μεταστατικού, μη πλακώδους, μη μικροκυτταρικού καρκίνου του πνεύμονα (NSCLC) σε ενήλικες, των οποίων οι όγκοι δεν έχουν EGFR ή ALK θετικές μεταλλάξεις
Η αποτελεσματικότητα του pembrolizumab σε συνδυασμό με χημειοθεραπεία με πεμετρεξίδη και πλατίνα, ερευνήθηκε στη μελέτη KEYNOTE-189. Τα κύρια κριτήρια ένταξης ήταν ο μεταστατικός, μη πλακώδης, μη μικροκυτταρικός καρκίνος του πνεύμονα (NSCLC), η μη λήψη προηγούμενης συστηματικής θεραπείας για τον μεταστατικό μη μικροκυτταρικό καρκίνο του πνεύμονα (NSCLC) και η μη ύπαρξη EGFR ή ALK γονιδιωματικών μεταλλάξεων όγκου. Ασθενείς με αυτοάνοση νόσο που απαιτούσε συστηματική θεραπεία εντός διαστήματος 2 ετών από την αγωγή, μια ιατρική κατάσταση που απαιτούσε ανοσοκαταστολή ή όσοι είχαν λάβει περισσότερο από 30 Gy ακτινοβολίας στο θώρακα κατά τις προηγούμενες 26 εβδομάδες δεν ήταν κατάλληλοι για να ενταχθούν. Οι ασθενείς τυχαιοποιήθηκαν (2:1) να λάβουν ένα από τα ακόλουθα δοσολογικά σχήματα:
- Pembrolizumab 200 mg με πεμετρεξίδη 500 mg/m 2 και σισπλατίνη 75 mg/m2 ή καρβοπλατίνη AUC 5 mg/ml/min, επιλογής του ερευνητή, ενδοφλεβίως, κάθε 3 εβδομάδες για 4 κύκλους, ακολουθούμενη από pembrolizumab 200 mg και πεμετρεξίδη 500 mg/m2 ενδοφλεβίως κάθε 3 εβδομάδες (n=410)
- Εικονικό φάρμακο με πεμετρεξίδη 500 mg/m 2 και σισπλατίνη 75 mg/m2 ή καρβοπλατίνη AUC 5 mg/ml/min, επιλογής του ερευνητή, ενδοφλεβίως, κάθε 3 εβδομάδες για 4 κύκλους, ακολουθούμενη από εικονικό φάρμακο και πεμετρεξίδη 500 mg/m 2 ενδοφλεβίως κάθε 3 εβδομάδες (n=206)
Η αγωγή με pembrolizumab συνεχίστηκε μέχρι την προσδιορισμένη με βάση τα κριτήρια RECIST 1.1, εξέλιξη της νόσου, όπως ορίστηκε από τον ερευνητή, μέχρι την εμφάνιση μη αποδεκτής τοξικότητας ή μέχρι ένα μέγιστο διάστημα 24 μηνών. Η χορήγηση του pembrolizumab επιτράπηκε και πέρα από την προσδιορισμένη με βάση τα κριτήρια RECIST, εξέλιξη της νόσου μέσω BICR ή πέρα από την διακοπή της πεμετρεξίδης, εάν ο ασθενής ήταν κλινικά σταθερός και προέκυπτε κλινικό όφελος, όπως ορίστηκε από τον ερευνητή. Για ασθενείς που ολοκλήρωσαν 24 μήνες θεραπείας ή είχαν πλήρη ανταπόκριση, θα μπορούσε να γίνει επανέναρξη της αγωγής με pembrolizumab σε εξέλιξη της νόσου και να χορηγηθεί για έως και 1 επιπρόσθετο έτος.
Η αξιολόγηση της κατάστασης του όγκου πραγματοποιούνταν την Εβδομάδα 6 και την Εβδομάδα 12 και κατόπιν κάθε 9 εβδομάδες. Στους ασθενείς που λάμβαναν εικονικό φάρμακο και χημειοθεραπεία και οι οποίοι εμφάνισαν ανεξάρτητα επιβεβαιωμένη εξέλιξη της νόσου, προσφέρθηκε το pembrolizumab ως μονοθεραπεία.
Επιδημιολογικά χαρακτηριστικά: διάμεση ηλικία 64 έτη (το 49 % είχε ηλικία 65 έτη ή μεγαλύτερη), 59 % άνδρες, 94 % Λευκοί , 3 % Ασιατικής καταγωγής, 43 %- 56 % ECOG 0- 1, 31 % με PD-L1 αρνητικό (TPS< 1%) και 18 % με εγκεφαλικές μεταστάσεις, για τις οποίες είχαν λάβει ή όχι προηγούμενη θεραπεία κατά την ένταξη. Ένα σύνολο 67 ασθενών στο θεραπευτικό σκέλος του εικονικού φαρμάκου με χημειοθεραπεία μετέβησαν στο άλλο θεραπευτικό σκέλος (crossed over), για να λάβουν τη μονοθεραπεία με pembrolizumab κατά την χρονική στιγμή της εξέλιξης της νόσου και 18 επιπρόσθετοι ασθενείς έλαβαν έναν αναστολέα σημείων ελέγχου ως επακόλουθη θεραπεία.
Τα πρωτεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν η OS και η PFS (όπως εκτιμήθηκαν μέσω της BICR χρησιμοποιώντας τα κριτήρια RECIST 1.1). Τα δευτερεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν το ORR και η διάρκεια της ανταπόκρισης, όπως εκτιμήθηκαν μέσω της BICR χρησιμοποιώντας τα κριτήρια RECIST 1.1. Στα 3 παρακάτω σχήματα φαίνονται τα τελικά αποτελέσματα με βάση την τελική ανάλυση μετά από διάμεση διάρκεια παρακολούθησης 18.8 μηνών.
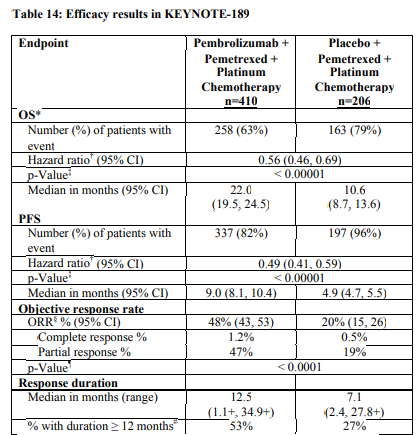
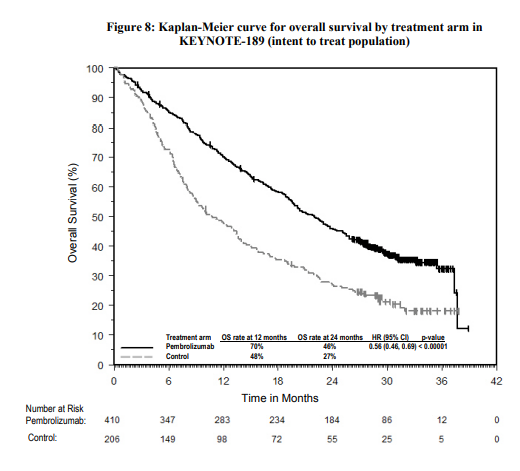
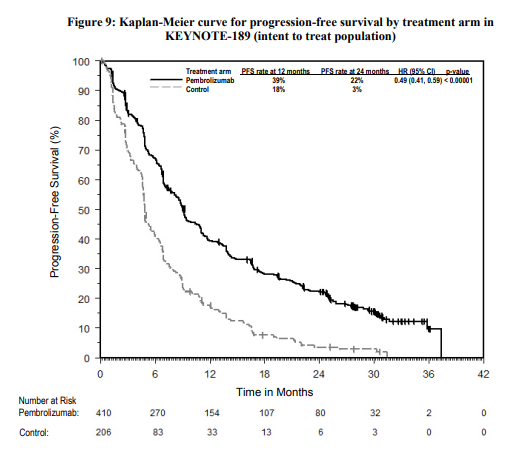
Διεξάχθηκε μια ανάλυση στην KEYNOTE-189 σε ασθενείς που είχαν έκφραση του PD-L1 με TPS< 1 % [συνδυασμός με pembrolizumab: n=127 (31 %) έναντι της χημειοθεραπείας: n=63 (31 %)], με TPS 1-49 % [συνδυασμός με pembrolizumab: n=128 (31 %) έναντι της χημειοθεραπείας: n=58 (28 %)] ή με ≥ 50 % [συνδυασμός με pembrolizumab: n=132 (32 %) έναντι της χημειοθεραπείας: n=70 (34 %)]
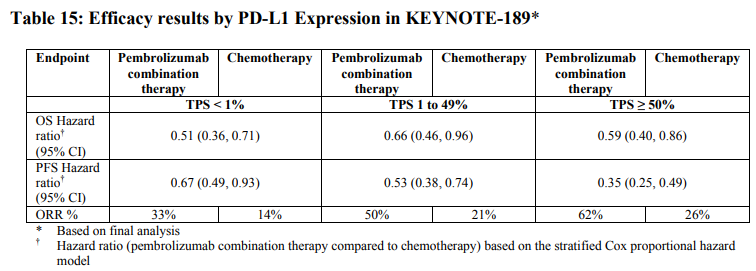
- Ένα σύνολο 57 ασθενών με μη μικροκυτταρικό καρκίνο του πνεύμονα (NSCLC) ηλικίας ≥ 75 ετών εντάχθηκαν στη μελέτη KEYNOTE-189 (35 στη συνδυαστική αγωγή με pembrolizumab και 22 στην ομάδα ελέγχου). Εντός αυτής της υποομάδας της μελέτης, καταδείχθηκε για την OS, HR=2,09 [95 % CI 0,84, 5,23] και για την PFS, HR=1,73 [95 % CI 0,77, 3,90] για την συνδυαστική αγωγή με pembrolizumab έναντι της χημειοθεραπείας. Τα δεδομένα για την αποτελεσματικότητα και ασφάλεια του pembrolizumab σε συνδυασμό με χημειοθεραπεία με πλατίνα είναι περιορισμένα σε αυτό τον πληθυσμό ασθενών.
4. Σε συνδυασμό με καρβοπλατίνη και είτε πακλιταξέλη, είτε πακλιταξέλη συνδεδεμένη με λευκωματίνη υπό μορφή νανοσωματιδίων (nabpaclitaxel), ως αγωγή πρώτης γραμμής του μεταστατικού, πλακώδους, μη μικροκυτταρικού καρκίνου του πνεύμονα (NSCLC) σε ενήλικες.
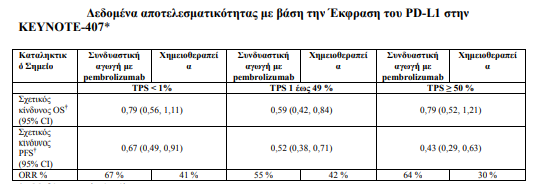
Η αποτελεσματικότητα του pembrolizumab σε συνδυασμό με καρβοπλατίνη και είτε πακλιταξέλη είτε πακλιταξέλη συνδεδεμένη με λευκωματίνη υπό μορφή νανοσωματιδίων, σε ασθενείς με Πλακώδες Καρκίνωμα Πνεύμονα ερευνήθηκε στη Μελέτη KEYNOTE-407 [ανεξαρτήτως της έκφρασης του PD-L1 στον όγκο και η μη λήψη προηγούμενης συστηματικής θεραπείας για τη μεταστατική νόσο].
Η διαστρωμάτωση της τυχαιοποίησης έγινε με βάση την έκφραση του PD-L1 στον όγκο (TPS< 1 % [αρνητική] έναντι TPS ≥ 1%), με βάση την επιλογή του ερευνητή όσον αφορά την πακλιταξέλη ή την πακλιταξέλη που είναι συνδεδεμένη με λευκωματίνη υπό μορφή νανοσωματιδίων και με βάση την γεωγραφική περιοχή (Ανατολική Ασία έναντι εκτός της Ανατολικής Ασίας). Οι ασθενείς τυχαιοποιήθηκαν (1:1) σε ένα από τα ακόλουθα θεραπευτικά σκέλη μέσω ενδοφλέβιας έγχυσης:
- Pembrolizumab 200 mg και καρβοπλατίνη AUC 6 mg/ml/min την Ημέρα 1 του καθε κύκλου διάρκειας 21-ημερών για 4 κύκλους και πακλιταξέλη 200 mg/m 2 την Ημέρα 1 του κάθε κύκλου διάρκειας 21-ημερών για 4 κύκλους ή πακλιταξέλη συνδεδεμένη με λευκωματίνη υπό μορφή νανοσωματιδίων 100 mg/m 2 , τις Ημέρες 1, 8 και 15 του κάθε κύκλου διάρκειας 21-ημερών για 4 κύκλους, ακολουθούμενη από pembrolizumab 200 mg κάθε 3 εβδομάδες. Το pembrolizumab χορηγούνταν πριν από τη χημειοθεραπεία την Ημέρα 1.
- Εικονικό φάρμακο και καρβοπλατίνη AUC 6 mg/ml/min την Ημέρα 1 του κάθε κύκλου διάρκειας 21-ημερών για 4 κύκλους και πακλιταξέλη 200 mg/m 2 την Ημέρα 1 του κάθε κύκλου διάρκειας 21-ημερών για 4 κύκλους ή πακλιταξέλη συνδεδεμένη με λευκωματίνη υπό μορφή νανοσωματιδίων 100 mg/m 2 , τις Ημέρες 1, 8 και 15 του κάθε κύκλου διάρκειας 21-ημερών για 4 κύκλους, ακολουθούμενη από εικονικό φάρμακο κάθε 3 εβδομάδες.
Η αγωγή με pembrolizumab ή εικονικό φάρμακο συνεχίστηκε μέχρι την προσδιορισμένη με βάση τα κριτήρια RECIST 1.1, εξέλιξη της νόσου, όπως ορίστηκε μέσω τυφλής, ανεξάρτητης, κεντρικής αξιολόγησης (BICR), μέχρι την εμφάνιση μη αποδεκτής τοξικότητας ή μέχρι ένα μέγιστο διάστημα 24 μηνών.
Η χορήγηση του pembrolizumab επιτράπηκε και πέρα από την προσδιορισμένη με βάση τα κριτήρια RECIST, εξέλιξη της νόσου, εάν ο ασθενής ήταν κλινικά σταθερός και προέκυπτε κλινικό όφελος, όπως ορίστηκε από τον ερευνητή. Στους ασθενείς που ήταν στο σκέλος του εικονικού φαρμάκου, προσφέρθηκε το pembrolizumab ως μονοθεραπεία κατά τη χρονική στιγμή της εξέλιξης της νόσου [ επιτρεπόμενο cross over]- 51% των ασθενών στο σκέλος του εικονικού φαρμάκου έκαναν crossover. Η αξιολόγηση της κατάστασης του όγκου πραγματοποιούνταν κάθε 6 εβδομάδες έως την Εβδομάδα 18, κάθε 9 εβδομάδες έως την Εβδομάδα 45 και κατόπιν κάθε 12 εβδομάδες.
Συνολικά τυχαιοποιήθηκαν 559 ασθενείς. Επιδημιολογικά χαρακτηριστικά: διάμεση ηλικία 65 έτη (εύρος: 29 έως 88), 55 % ηλικίας >=65 ετών , 81 % άνδρες, 77 % ήταν Λευκοί,29 % - 71 %, ECOG 0 και 1 αντιστοίχως, 8 % με εγκεφαλικές μεταστάσεις, για τις οποίες είχε λάβει θεραπεία κατά την ένταξη. 35% είχε έκφραση PDL1 στον όγκο TPS< 1 % [αρνητική]. 19% ήταν από την Ανατολική Ασία και το 60 % έλαβε πακλιταξέλη.
Τα πρωτεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν η OS και η PFS (όπως εκτιμήθηκαν μέσω της BICR χρησιμοποιώντας τα κριτήρια RECIST 1.1). Τα δευτερεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν το ORR και η διάρκεια της ανταπόκρισης, όπως εκτιμήθηκαν μέσω της BICR χρησιμοποιώντας τα κριτήρια RECIST 1.1. Η διάμεση περίοδος παρακολούθησης ήταν 7,8 μήνες (εύρος: 0,1 έως 19,1 μήνες).
Πίνακας 9:
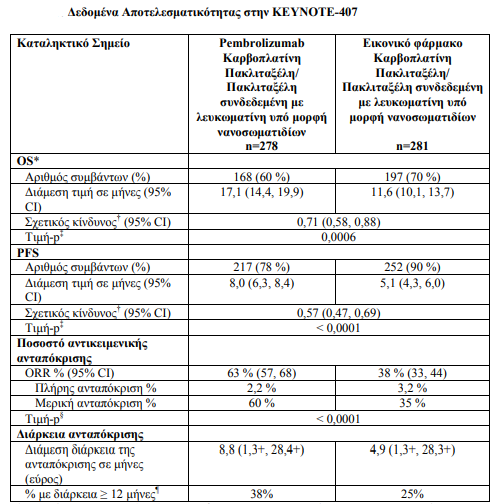
- Σε ασθενείς που είχαν έκφραση του PD-L1 με TPS< 1 % [με pembrolizumab συν το θεραπευτικό σκέλος της χημειοθεραπείας: 34 % έναντι του εικονικού φαρμάκου συν το θεραπευτικό σκέλος της χημειοθεραπείας: 35 %], με TPS 1 % έως 49 % [με pembrolizumab συν το θεραπευτικό σκέλος της χημειοθεραπείας: 37 % έναντι του εικονικού φαρμάκου συν το θεραπευτικό σκέλος της χημειοθεραπείας: 37 %] ή με TPS ≥ 50 % [με pembrolizumab συν το θεραπευτικό σκέλος της χημειοθεραπείας:26 % έναντι του εικονικού φαρμάκου συν το θεραπευτικό σκέλος της χημειοθεραπείας: 26 %]
Πίνακας 10:
- Συνολικά 65 ασθενείς με μη μικροκυτταρικό καρκίνο του πνεύμονα (NSCLC), ηλικίας ≥ 75 ετών, εντάχθηκαν στη μελέτη KEYNOTE-407 (34 στην συνδυαστική αγωγή με pembrolizumab και 31 στην ομάδα ελέγχου). Εντός αυτής της υποομάδας της μελέτης, καταγράφηκε για την OS, HR=0,96 [95 % CI 0,37, 2,52], για την PFS, HR=0,60 [95 % CI 0,29, 1,21] και ORR 47 % για τη συνδυαστική αγωγή με pembrolizumab έναντι 42 % για τη χημειοθεραπεία. Τα δεδομένα για την αποτελεσματικότητα και ασφάλεια του pembrolizumab σε συνδυασμό με χημειοθεραπεία με πλατίνα είναι περιορισμένα σε αυτό τον πληθυσμό ασθενών.
Καρκίνωμα του ουροθηλίου
1. Σε ασθενείς με καρκίνωμα ουροθηλίου που έχουν λάβει προηγούμενη αγωγή με χημειοθεραπεία με αγωγή που περιείχε πλατίνα
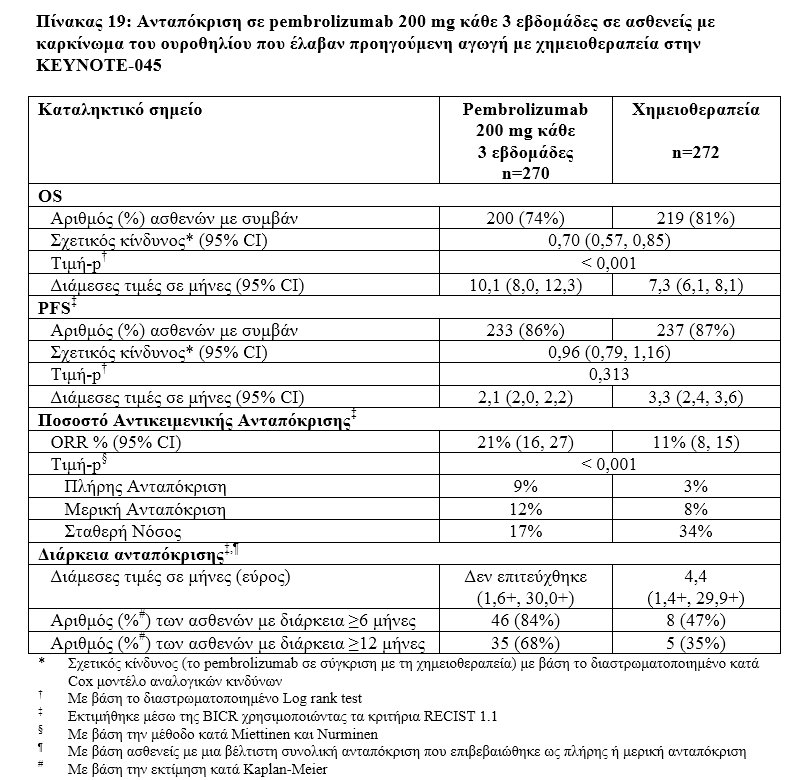
Η ασφάλεια και η αποτελεσματικότητα του pembrolizumab αξιολογήθηκαν στη μελέτη ΚΕΥΝΟΤΕ-045,[πολυκεντρική, τυχαιοποιημένη (1:1)], ελεγχόμενη μελέτη για τη θεραπεία του τοπικά προχωρημένου ή μεταστατικού καρκινώματος του ουροθηλίου σε ασθενείς με εξέλιξη της νόσου κατά τη διάρκεια ή μετά από αγωγή με χημειοθεραπεία που περιείχε πλατίνα. Οι ασθενείς θα πρέπει να έχουν λάβει σχήμα πρώτης γραμμής που περιέχει πλατίνα για την τοπικά προχωρημένη/μεταστατική νόσο ή ως νεοεπικουρική/επικουρική αγωγή, με υποτροπή/εξέλιξη ≤12 μήνες μετά την ολοκλήρωση της θεραπείας.
Οι ασθενείς τυχαιοποιήθηκαν να λάβουν είτε KEYTRUDA 200 mg κάθε 3εβδομάδες (n=270) είτε οποιοδήποτε από τα ακόλουθα σχήματα χημειοθεραπείας επιλογής του ερευνητή, χορηγούμενα όλα ενδοφλεβίως κάθε 3εβδομάδες (n=272): πακλιταξέλη 175mg/m2, ντοσεταξέλη 75mg/m2 ή βινφλουνίνη320mg/m2. Οι ασθενείς έλαβαν pembrolizumab μέχρι την εμφάνιση μη αποδεκτής τοξικότητας ή μέχρι την εξέλιξη της νόσου (έως και 24μήνες).
- Η μελέτη απέκλειε ασθενείς με αυτοάνοση νόσο, κάποια ιατρική κατάσταση που απαιτούσε ανοσοκαταστολή και ασθενείς με περισσότερες από 2 προηγούμενες γραμμές συστηματικής χημειοθεραπείαςγια τον μεταστατικό ουροθηλιακό καρκίνο. Ασθενείς με βαθμολογία κατάστασης λειτουργικότητας κατά ECOG2 έπρεπε να έχουν αιμοσφαιρίνη≥10g/dl, δεν έπρεπε να έχουν ηπατικές μεταστάσεις και έπρεπε να έχουν λάβει την τελευταία δόση του πιο πρόσφατου προηγούμενου σχήματος χημειοθεραπείας ≥3μήνες πριν από την ένταξή τους.
Επιδημιολογικά χαρακτηριστικά: διάμεση ηλικία 66έτη (εύρος: 26 έως 88), 58% ηλικίας>= 65 ετών, το 74% ήταν άνδρες, 72% ήταν Λευκοί- 23% Ασιατικής καταγωγής, 56% είχε ECOG1 και μόνο 1% με ECOG2, 96% με Μ1 νόσο και 4% με Μ0 νόσο. 85% είχε σπλαχνικές μεταστάσεις, συμπεριλαμβανομένου 34% με ηπατικές μεταστάσεις, 86% είχε πρωτοπαθή όγκο στο κατώτερο ουροποιητικό σύστημα, 15% είχε εξέλιξη της νόσου μετά από προηγούμενη νεοεπικουρική ή επικουρική χημειοθεραπεία που περιείχε πλατίνα,21% είχε λάβει 2 προηγούμενα συστηματικά σχήματα για μεταστατική νόσο και 76% είχε λάβει προηγούμενη θεραπεία με σισπλατίνη.
Τα πρωτεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν η OS και η PFS όπως εκτιμήθηκαν μέσω της BICR χρησιμοποιώντας τα κριτήρια RECIST v1.1.Ταδευτερεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν το ORR (όπως εκτιμήθηκε μέσω της BICR χρησιμοποιώντας τα κριτήρια RECIST v1.1)και η διάρκεια της ανταπόκρισης.
Η μελέτη επέδειξε στατιστικά σημαντικές βελτιώσεις στην OS και στο ORR στους ασθενείς που τυχαιοποιήθηκαν να λάβουν pembrolizumab σε σύγκριση με τη χημειοθεραπεία. Δεν υπήρξε στατιστικά σημαντική διαφορά μεταξύ του pembrolizumabκαι της χημειοθεραπείας όσον αφορά την PFS.
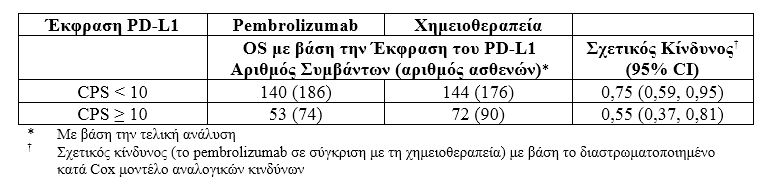
Διεξάχθηκε μία ανάλυση στην KEYNOTE-045 σε ασθενείς, οι οποίοι είχαν CPS του PD-L1<10 [pembrolizumab: n=186(69%)έναντι της χημειοθεραπείας: n=176 (65%)] ή ≥10 [pembrolizumab: n=74 (27%) έναντι της χημειοθεραπείας: n= 90 (33%)] και στα δύο θεραπευτικά σκέλη του pembrolizumab και της χημειοθεραπείας
Πίνακας 12: OS με βάση την Έκφραση του PD-L1
- Οι αναφερόμενες από τους ασθενείς εκβάσεις (PROs) αξιολογήθηκαν με χρήση των EORTC QLQC30. Ένας παρατεταμένος χρόνος έως την επιδείνωση στο γενικό επίπεδο υγείας/ποιότητα ζωής (QoL) στα EORTC QLQ-C30, παρατηρήθηκε σε ασθενείς που έλαβαν θεραπεία με pembrolizumab σε σύγκριση με τη χημειοθεραπεία επιλογής του ερευνητή (HR 0,70, 95 % CI 0,55-0,90)[ Αυτά τα αποτελέσματα θα πρέπει να ερμηνεύονται στο πλαίσιο του ανοιχτού σχεδιασμού της μελέτης και επομένως θα πρέπει να αντιμετωπίζονται με επιφύλαξη].
2. Ως μονοθεραπεία, ενδείκνυται ως αγωγή του τοπικά προχωρημένου ή μεταστατικού καρκινώματος του ουροθηλίου σε ενήλικες, οι οποίοι δεν είναι κατάλληλοι για αγωγή χημειοθεραπείας που περιέχει σισπλατίνη και των οποίων οι όγκοι εκφράζουν το PD-L1 με συνδυαστική θετική βαθμολογία (CPS) ≥ 10
Η ασφάλεια και η αποτελεσματικότητα του pembrolizumab ερευνήθηκαν στη μελέτη ΚΕΥΝΟΤΕ-052, σε ασθενείς 370 με τοπικά προχωρημένο ή μεταστατικό καρκίνωμα του ουροθηλίου που δεν ήταν κατάλληλοι για να λάβουν αγωγή χημειοθεραπείας που περιέχει σισπλατίνη. Οι ασθενείς έλαβαν το pembrolizumab σε δόση των 200mg κάθε 3 εβδομάδες μέχρι την εμφάνιση μη αποδεκτής τοξικότητας ή μέχρι την εξέλιξη της νόσου. Η αγωγή μπορούσε να συνεχιστεί και πέρα από τηνεξέλιξη της νόσου εάν ο ασθενής ήταν κλινικά σταθερός και θεωρούνταν από τον ερευνητή ότι προκύπτει κλινικό όφελος [έως και 24μήνες].
Επιδημιολογικά χαρακτηριστικά: διάμεση ηλικία 74έτη ( 82%>=65 έτη ), 77% ήταν άνδρες, 89% Λευκοί, 7% Ασιατικής καταγωγής, 88% με Μ1 νόσο, 85% με σπλαχνικές μεταστάσεις ( 21% με ηπατικές μεταστάσεις), 90% δεν είχε λάβει προηγούμενη αγωγή, 81% με πρωτοπαθή όγκο στο κατώτερο ουροποιητικό σύστημα.
- Οι λόγοι για την μη καταλληλότητα των ασθενών για αγωγή σισπλατίνης περιλάμβαναν: κάθαρση κρεατινίνης κατά την ένταξη <60ml/min (50%), κατάστασηλειτουργικότητας κατά ECOG2 (32%), κατάσταση λειτουργικότητας κατά ECOG2 και κάθαρση κρεατινίνης κατά την ένταξη <60ml/min(9%) και άλλοιλόγοι(καρδιακή ανεπάρκεια Κατηγορίας ΙΙΙ, περιφερική νευροπάθεια Βαθμού2 ή μεγαλύτερου και απώλεια ακοής Βαθμού2 ή μεγαλύτερου, 9%).
Το πρωτεύον σημείο έκβασης της αποτελεσματικότητας ήταν το ORR όπως εκτιμήθηκε μέσω της BICR χρησιμοποιώντας τα κριτήρια RECIST 1.1.Τα δευτερεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν η διάρκεια της ανταπόκρισης, η PFSκαι η OS.

- Διεξάχθηκε μια ανάλυση στην KEYNOTE-052 σε ασθενείς, οι οποίοι είχαν όγκους που εξέφραζαν το PD-L1 με CPS<10 (68%) ή ≥10 ( 30%) με βάση τον ανοσοϊστοχημικό (IHC) έλεγχο με το 22C3pharmDxTM Kit του PD-L1

Η KEYNOTE-361 είναι μία Φάσης ΙΙΙ, σε εξέλιξη, τυχαιοποιημένη, ελεγχόμενη, ανοιχτού σχεδιασμού κλινική μελέτη του pembrolizumab με ή χωρίς συνδυαστική χημειοθεραπεία με βάση την πλατίνα έναντι της χημειοθεραπείας ως πρώτη γραμμή θεραπείας σε άτομα με προχωρημένο ή μεταστατικό καρκίνωμα του ουροθηλίου. Τα προκαταρκτικά δεδομένα από μία πρώιμη ανασκόπηση έδειξαν μειωμένη επιβίωση με τη μονοθεραπεία με pembrolizumab σε ασθενείς, των οποίων οι όγκοι εκφράζουν το PD-L1 με CPS < 10. Το θεραπευτικό σκέλος της μονοθεραπείας με pembrolizumab παραμένει ανοιχτό μόνο σε ασθενείς, των οποίων οι όγκοι εκφράζουν το PD-L1 με CPS ≥ 10. Τα άτομα, των οποίων οι όγκοι εκφράζουν το PD-L1 με CPS < 10 που έχουν ήδη ενταχθεί στο σκέλος της μονοθεραπείας με pembrolizumab, μπορούν να συνεχίσουν την αγωγή. Η τυχαιοποίηση στα θεραπευτικά σκέλη της χημειοθεραπείας και της χημειοθεραπείας-pembrolizumab παραμένει ανοιχτή.
Καρκίνωμα Κεφαλής και Τραχήλου
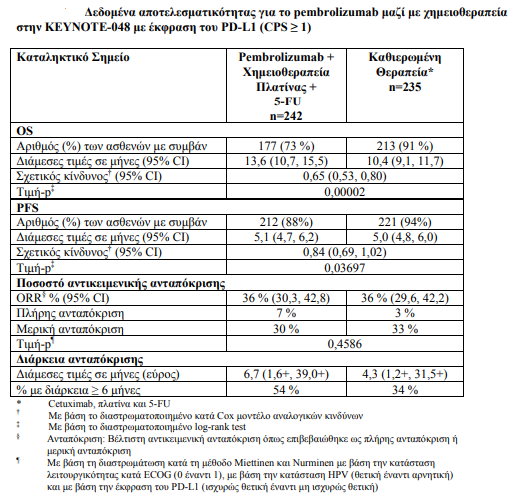
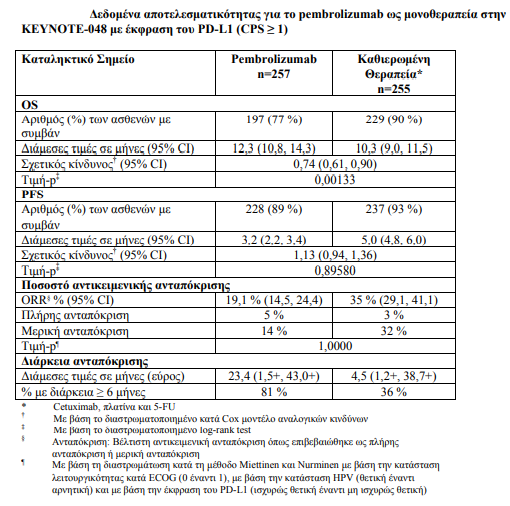
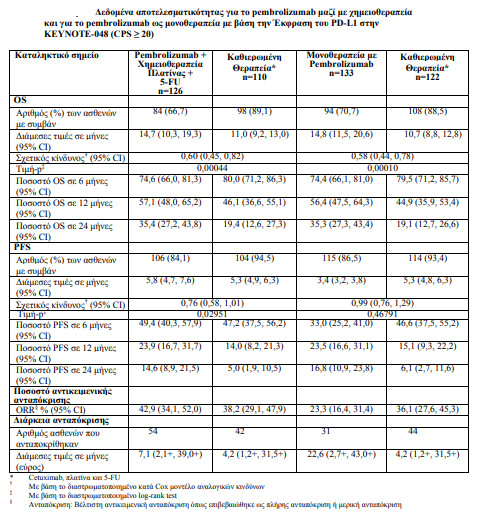
1. Ως μονοθεραπεία ή σε συνδυασμό με χημειοθεραπεία με πλατίνα και 5- φθοριοουρακίλη (5-FU), ενδείκνυται ως αγωγή πρώτης γραμμής του μεταστατικού ή ανεγχείρητου υποτροπιάζοντος καρκινώματος κεφαλής και τραχήλου εκ πλακωδών κυττάρων σε ενήλικες, των οποίων οι όγκοι εκφράζουν το PD-L1 με CPS ≥ 1
Η αποτελεσματικότητα του pembrolizumab ερευνήθηκε σε ασθενείς με επιβεβαιωμένο ιστολογικά μεταστατικό ή υποτροπιάζον καρκίνωμα κεφαλής και τραχήλου εκ πλακωδών κυττάρων (HNSCC) στη στοματική κοιλότητα, στο φάρυγγα ή στο λάρυγγα, οι οποίοι δεν είχαν λάβει προηγούμενη συστηματική θεραπεία για την υποτροπιάζουσα ή μεταστατική νόσο και οι οποίοι θεωρούνταν μη ιάσιμοι από τις τοπικές θεραπείες στη μελέτη KEYNOTE-048,
Κριτήρια αποκλεισμού: Οι ασθενείς με καρκίνωμα του ρινοφάρυγγα, με ενεργή αυτοάνοση νόσο που απαιτούσε συστηματική θεραπεία εντός διαστήματος δύο ετών από την αγωγή ή με ιατρική κατάσταση που απαιτούσε ανοσοκαταστολή δεν ήταν κατάλληλοι για να ενταχθούν στη μελέτη.
Η διαστρωμάτωση της τυχαιοποίησης έγινε με βάση: την έκφραση του PD-L1 στoν όγκο (TPS ≥ 50 % ή < 50 %), την κατάσταση HPV (θετική ή αρνητική) και την κατάσταση λειτουργικότητας κατά ECOG PS (0 έναντι 1).
Οι ασθενείς τυχαιοποιήθηκαν 1:1:1 σε ένα από τα ακόλουθα θεραπευτικά σκέλη:
-Pembrolizumab 200 mg κάθε 3 εβδομάδες
-Pembrolizumab 200 mg κάθε 3 εβδομάδες, καρβοπλατίνη AUC 5 mg/ml/min κάθε
- 3 εβδομάδες ή σισπλατίνη 100 mg/m2 κάθε 3 εβδομάδες και 5-φθοριοουρακίλη (5-FU) 1.000 mg/m2 /ημέρα για 4 ημέρες συνεχόμενες κάθε 3 εβδομάδες (μέγιστο των 6 κύκλων πλατίνας και 5-φθοριοουρακίλης (5-FU)) Cetuximab 400 mg/m2 δόση εφόδου, κατόπιν 250 mg/m2 μία φορά εβδομαδιαίως, καρβοπλατίνη AUC 5 mg/ml/min κάθε 3 εβδομάδες ή σισπλατίνη 100 mg/m2 κάθε 3 εβδομάδες και 5-φθοριοουρακίλη (5-FU) 1.000 mg/m2 /ημέρα για 4 ημέρες συνεχόμενες κάθε 3 εβδομάδες (μέγιστο των 6 κύκλων πλατίνας και 5-φθοριοουρακίλης (5-FU)
Μεταξύ των 882 ασθενών στην KEYNOTE-048, 85 % είχαν όγκους που εξέφραζαν το PD-L1 με CPS ≥ 1 με βάση τον ανοσοϊστοχημικό (IHC) έλεγχο με το 22C3 pharmDxTM Kit του PD-L1. Τα χαρακτηριστικά αυτών των 754 ασθενών κατά την ένταξη περιλάμβαναν: διάμεση ηλικία 61 έτη, 36 % ήταν ηλικίας >=65 ετών, 82 % ήταν άνδρες, 74 % ήταν Λευκοί, 19 % ήταν Ασιατικής καταγωγής,61 % ECOG, 77 % ήταν πρώην καπνιστές/καπνιστές, 21 % HPV θετικοί, 95 % ήταν σε στάδιο IV (στάδιο IVa 21 %, στάδιο IVb 6 % και στάδιο IVc 69 %).
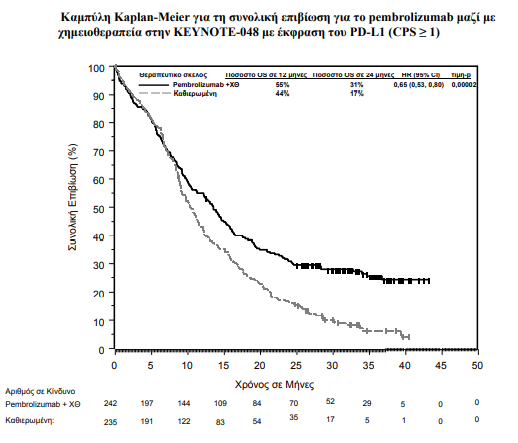
Τα πρωτεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν η OS και η PFS (όπως εκτιμήθηκαν μέσω της BICR σύμφωνα με τα κριτήρια RECIST 1.1). Η μελέτη επέδειξε στατιστικά σημαντική βελτίωση στην OS σε όλους τους ασθενείς που τυχαιοποιήθηκαν στο pembrolizumab σε συνδυασμό με χημειοθεραπεία σε σύγκριση με την καθιερωμένη θεραπεία (HR 0,72, 95 % CI 0,60- 0,87) και σε ασθενείς, των οποίων οι όγκοι εξέφραζαν το PD-L1 με CPS ≥ 1, οι οποίοι τυχαιοποιήθηκαν στη μονοθεραπεία με pembrolizumab σε σύγκριση με την καθιερωμένη θεραπεία.
2. Ως μονοθεραπεία, για αγωγή του υποτροπιάζοντος ή μεταστατικού καρκινώματος κεφαλής και τραχήλου εκ πλακωδών κυττάρων σε ενήλικες, των οποίων οι όγκοι εκφράζουν το PD-L1 με βαθμολογία αναλογίας όγκου (TPS) ≥ 50 % και εμφανίζουν εξέλιξη της νόσου κατά τη διάρκεια ή μετά από αγωγή χημειοθεραπείας που περιείχε πλατίνα
Η ασφάλεια και η αποτελεσματικότητα του pembrolizumab σε ασθενείς με υποτροπιάζον ή μεταστατικό HNSCC στη στοματική κοιλότητα, στο φάρυγγα ή στο λάρυγγα, που είχαν εξέλιξη της νόσου κατά τη διάρκεια ή μετά από αγωγή με χημειοθεραπεία που περιείχε πλατίνα, ερευνήθηκαν KEYNOTE-040. Το Pembrolizumab χορηγήθηκε ως μέρος θεραπείας επαγωγής, ταυτόχρονης ή επικουρικής θεραπείας σε ασθενείς οι οποίοι δεν ήταν κατάλληλοι για τοπική θεραπεία με πρόθεση για ίαση.
Η διαστρωμάτωση έγινε με βάση την έκφραση του PDL1(TPS ≥ 50%), την κατάσταση HPV και την κατάσταση λειτουργικότητας κατά ECOG.
Τυχαιοποιήθηκαν (1:1) να λάβουν είτε
-Pembrolizumab 200 mg κάθε 3 εβδομάδες
-είτε μία από τις τρεις καθιερωμένες θεραπείες : μεθοτρεξάτη 40 mg/m2 μία φορά την εβδομάδα, δοσεταξέλη 75 mg/m2 μία φορά κάθε 3 εβδομάδες ή cetuximab με 400 mg/m2 ως δόση εφόδου και κατόπιν 250 mg/m2 μία φορά την εβδομάδα.
Κριτήρια αποκλεισμού: ασθενείς με καρκίνωμα του ρινοφάρυγγα, με ενεργή αυτοάνοση νόσο που απαιτούσε συστηματική θεραπεία εντός διαστήματος 2 ετών από την αγωγή, με ιατρική κατάσταση που απαιτούσε ανοσοκαταστολή ή όσους είχαν λάβει προηγούμενη συστηματική αγωγή με 3 ή περισσότερα σχήματα για υποτροπιάζον ή/και μεταστατικό HNSC.
Από τους 495 ασθενείς στην KEYNOTE-040, 26 % είχαν όγκους με έκφραση του PD-L1με TPS ≥ 50 % με βάση τον ανοσοϊστοχημικό (IHC) έλεγχο με το 22C3 pharmDxTM Kit του PDL1.
Επιδημιολογικά χαρακτηριστικα: διάμεση ηλικία 62 έτη, 81 % άνδρες, 78% Λευκοί, 11 % Ασιατικής καταγωγής , 23 % -77 % ECOG 0-1 αντίστοιχα, 19 % με HPV θετικούς όγκους, 67 % σε στάδιο Μ1 και η πλειοψηφία ήταν σε Στάδιο IV (Στάδιο IV 32 %, Στάδιο IVa 14% , Στάδιο IVb 4 % και Στάδιο IVc 44%).16 % είχαν εξέλιξη της νόσου μετά από νεοεπικουρική ή επικουρική χημειοθεραπεία που περιείχε πλατίνα και το 84 % είχε λάβει 1-2 προηγούμενα συστηματικά δοσολογικά σχήματα για τη μεταστατική νόσο.
Τα πρωτεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν η OS στον πληθυσμό ΙΤΤ. Από την αρχική ανάλυση προέκυψε HR για την OS 0,82 (95 % CI: 0,67, 1,01) με μονομερή τιμή-p 0,0316. Η διάμεση OS ήταν 8,4 μήνες για το pembrolizumab σε σύγκριση με τους 7,1 μήνες για την καθιερωμένη θεραπεία.
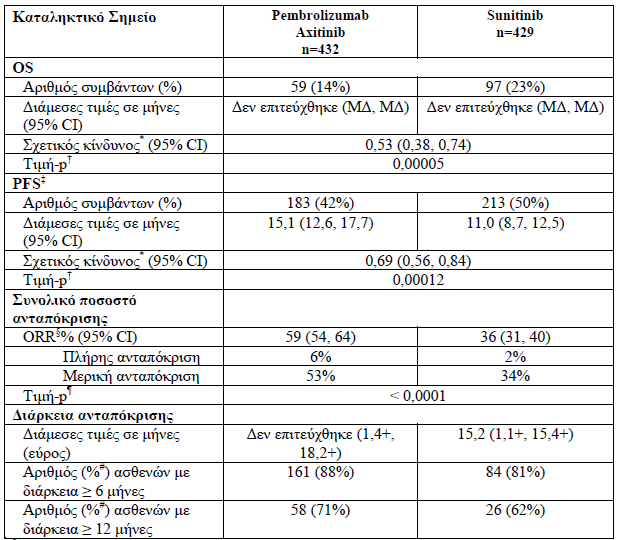
3. Το KEYTRUDA σε συνδυασμό με το axitinib, ενδείκνυται ως αγωγή πρώτης γραμμής του προχωρημένου καρκινώματος των νεφρών σε ενήλικες
Η αποτελεσματικότητα του pembrolizumab σε συνδυασμό με το axitinib σε ασθενείς με προχωρημένο καρκίνωμα των νεφρών (RCC) με διαυγοκυτταρικό στοιχείο, ανεξαρτήτως της έκφρασης του PD-L1 στον όγκο και ανεξάρτητα από τις κατηγορίες των ομάδων κινδύνου με βάση τη Διεθνή Κοινοπραξία της Βάσης Δεδομένων για το Μεταστατικό RCC (IMDC) ερευνήθηκε στην
KEYNOTE-426.
Η δοκιμή απέκλεισε ασθενείς με αυτοάνοση νόσο ή μια ιατρική κατάσταση που απαιτούσε ανοσοκαταστολή.
Η διαστρωμάτωση της τυχαιοποίησης έγινε με βάση τις κατηγορίες κινδύνου (ευνοϊκή έναντι ενδιάμεσης έναντι πτωχής) και με βάση τη γεωγραφική περιοχή (Βόρεια Αμερική έναντι Δυτικής Ευρώπης έναντι του «Υπόλοιπου Κόσμου»).
Οι ασθενείς τυχαιοποιήθηκαν (1:1) σε ένα από τα ακόλουθα θεραπευτικά σκέλη:
- Pembrolizumab 200 mg ενδοφλεβίως κάθε 3 εβδομάδες σε συνδυασμό με axitinib 5 mg δύο φορές ημερησίως από του στόματος. Στους ασθενείς που είχαν καλή ανοχή στο axitinib η δόση μπορεί να κλιμακωθεί έως τα 10 mg δύο φορές ημερησίως
- Sunitinib 50 mg από του στόματος μία φορά ημερησίως για 4 εβδομάδες και κατόπιν διακοπή της θεραπείας για 2 εβδομάδες.
Η αγωγή με το pembrolizumab και το axitinib συνεχίστηκε μέχρι την εξέλιξη της νόσου ή μέχρι μη αποδεκτή τοξικότητα επιβεβαιωμένη από τον ερευνητή ή για το pembrolizumab μέχρι ένα μέγιστο διάστημα 24 μηνών. Η χορήγηση του pembrolizumab και του axitinib επιτράπηκε και πέρα από την προσδιορισμένη με βάση τα κριτήρια RECIST, εξέλιξη της νόσου, εάν ο ασθενής ήταν κλινικά σταθερός και θεωρούνταν από τον ερευνητή ότι προκύπτει κλινικό όφελος. Η αξιολόγηση της κατάστασης του όγκου πραγματοποιούνταν κατά την ένταξη, μετά την τυχαιοποίηση την Εβδομάδα 12, στη συνέχεια κάθε 6 εβδομάδες μέχρι την Εβδομάδα 54και κατόπιν κάθε 12 εβδομάδες. Οι χημικοί και αιματολογικοί εργαστηριακοί έλεγχοι πραγματοποιούνταν σε κάθε κύκλο.
Επιδημιολογικά χαρακτηριστικά των 861 ασθενών: διάμεση ηλικία 62 έτη, 38 % ήταν ηλικίας>= 65 ετών,73 % άνδρες, 79 % Λευκοί, 16 % Ασιατικής καταγωγής, 80 % με KPS 90-100, 20 % με KPS 70-80. Η κατανομή των ασθενών με βάση τις κατηγορίες κινδύνου κατά IMDC ήταν 31 % ευνοϊκή, 56 % ενδιάμεση και 13 % πτωχή.
Τα πρωτεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν η OS και η PFS (όπως
εκτιμήθηκαν μέσω της BICR χρησιμοποιώντας τα κριτήρια RECIST 1.1). Τα δευτερεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν το ORR και η διάρκεια της ανταπόκρισης, όπως εκτιμήθηκαν μέσω της BICR χρησιμοποιώντας τα κριτήρια RECIST 1.1. Η διάμεση περίοδος παρακολούθησης ήταν 12,8 μήνες (εύρος: 0,1 έως 21,5 μήνες)
- Τα οφέλη της OS και της PFS παρατηρήθηκαν ανεξαρτήτως του επιπέδου έκφρασης του PD-L1 και της ομάδας κινδύνου κατά IMDC που ανήκαν οι ασθενείς.
Η δοκιμή KEYNOTE-426 δεν είχε την ισχύ να αξιολογήσει την αποτελεσματικότητα στις ξεχωριστές υποομάδες.
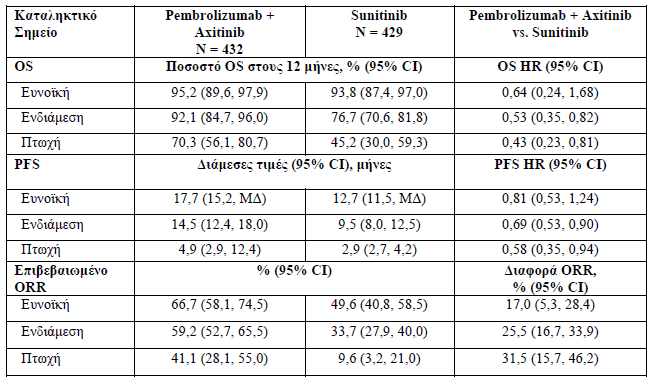
Διεξάχθηκε μία επικαιροποιημένη ανάλυση της OS όταν οι ασθενείς είχαν μια διάμεση περίοδο παρακολούθησης των 16,6 μηνών.
- Κατά τη χρονική στιγμή αυτής της ανάλυσης, ο σχετικός κίνδυνος στο σύνολο του πληθυσμού (95 % CI) ήταν 0,59 (0,45, 0,78) με 84/432 (19,4 %) συμβάντα στο σκέλος της συνδυαστικής αγωγής και 122/429 (28,4 %) συμβάντα στο σκέλος του sunitinib. Το ποσοστό της OS στους 12 μήνες ήταν 89,5 % για το pembrolizumab σε συνδυασμό με το axitinib και 78,8 % για το sunitinib.
- Το ποσοστό της OS στους 18 μήνες ήταν 81,0 % για το pembrolizumab σε συνδυασμό με το axitinib και 70,7 % για το sunitinib. Για την κατηγορία κινδύνου κατά IMDC, ο σχετικός κίνδυνος της OS για την ευνοϊκή ομάδα κινδύνου ήταν 0,94 , για την ενδιάμεση ομάδα κινδύνου ο σχετικός κίνδυνος της OS ήταν 0,52 και για την πτωχή ομάδα κινδύνου ο σχετικός κίνδυνος της OS ήταν 0,50.
Ορθοκολικός καρκίνος
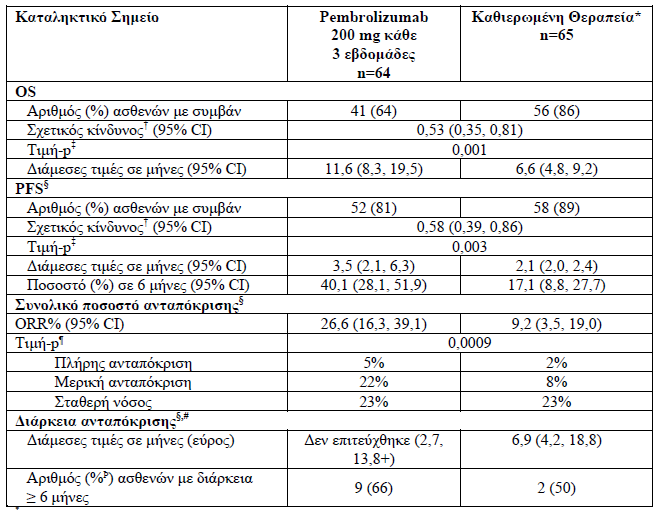
1. Σε ασθενείς με Ορθοκολικό καρκίνο υψηλής μικροδορυφορικής αστάθειας (MSI-H) ή με ανεπάρκεια επιδιόρθωσης αταίριαστων ζευγών βάσεων (dMMR) που δεν είχαν λάβει προηγούμενη θεραπεία για τη μεταστατική νόσο
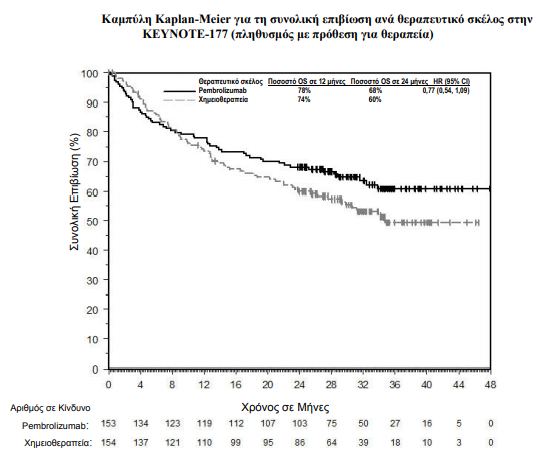
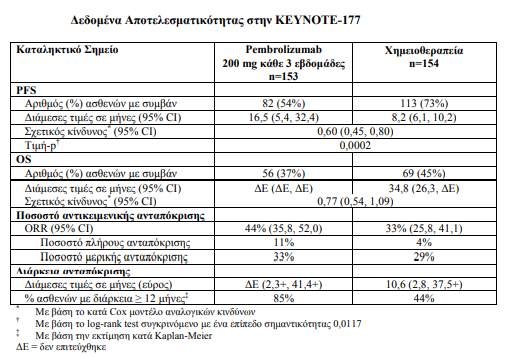
Η αποτελεσματικότητα του pembrolizumab σε αυτούς τους ασθενείς ερευνήθηκε στην KEYNOTE-177, σε σύγκειση με ενεργό παράγοντα.
Ο έλεγχος της κατάστασης του όγκου για MSI ή MMR πραγματοποιήθηκε τοπικά με τη χρήση αλυσιδωτής αντίδρασης πολυμεράσης (PCR) ή ανοσοϊστοχημικού (IHC) ελέγχου, αντίστοιχα.
Οι ασθενείς τυχαιοποιήθηκαν (1:1) ώστε να λάβουν είτε :
-pembrolizumab 200 mg ενδοφλεβίως κάθε 3 εβδομάδες
-είτε ένα από τα ακόλουθα χημειοθεραπευτικά σχήματα επιλογής του ερευνητή, χορηγούμενα ενδοφλεβίως κάθε 2 εβδομάδες: • mFOLFOX6 ή mFOLFOX6 σε συνδυασμό είτε με bevacizumab είτε με cetuximab • FOLFIRI ή FOLFIRI σε συνδυασμό είτε με bevacizumab είτε με cetuximab.
Η αγωγή με pembrolizumab συνεχίστηκε μέχρι την προσδιορισμένη με βάση τα κριτήρια RECIST 1.1, εξέλιξη της νόσου, όπως ορίστηκε από τον ερευνητή ή μέχρι μη αποδεκτή τοξικότητα. Οι ασθενείς που έλαβαν pembrolizumab και δεν παρουσίασαν εξέλιξη της νόσου θα μπορούσαν να συνεχίσουν την αγωγή για διάστημα έως και 24 μήνες. Η αξιολόγηση της κατάστασης του όγκου πραγματοποιούνταν κάθε 9 εβδομάδες. Στη μελέτη επιτρεπόταν το crossover κατά τη χρονική στιγμή της εξέλιξης της νόσου.
Συνολικά 307 ασθενείς εντάχθηκαν και τυχαιοποιήθηκαν σε pembrolizumab (n=153) ή σε χημειοθεραπεία (n=154). Τα χαρακτηριστικά αυτών των ασθενών κατά την ένταξη ήταν: διάμεση ηλικία 63 έτη (εύρος: 24 έως 93), το 47 % ήταν ηλικίας 65 ετών ή μεγαλύτερης, το 50 % ήταν άνδρες, το 75 % ήταν Λευκοί και το 16 % ήταν Ασιατικής καταγωγής. Το 52 % και το 48 % με βαθμολογία κατάστασης λειτουργικότητας κατά ECOG 0 ή 1 αντίστοιχα. Η κατάσταση μετάλλαξης ήταν: 25 % με BRAF V600E, 24 % με KRAS/NRAS. Από τους 143 ασθενείς που έλαβαν αγωγή χημειοθεραπείας, το 56 % έλαβε mFOLFOX6 με ή χωρίς bevacizumab ή cetuximab και το 44 % έλαβε FOLFIRI με ή χωρίς bevacizumab ή cetuximab. Τα πρωτεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν η PFS όπως εκτιμήθηκε μέσω της BICR σύμφωνα με τα κριτήρια RECIST v1.1 και η OS. Τα δευτερεύοντα σημεία έκβασης ήταν το ORR και η διάρκεια της ανταπόκρισης [διάμεση περίοδο παρακολούθησης 27,6 μηνών].
FDA Ενδείξεις (δεν περιλαμβάνονται ακόμα στην Ευρώπη):
- Μικροκυτταρικό Καρκίνωμα Πνεύμονα(SCLC)
Σε ασθενείς που η νόσος προοδεύει μετά από πλατινούχο χημειοθεραπεία και τουλάχιστον μία ακόμα γραμμή θεραπείας
(18/06/2019)
- Τριπλά αρνητικό καρκίνωμα μαστού, με όγκους που εκφράζουν PD-L1 (CPS>=10)
Σε ασθενείς με τοπικά προχωρημένο μη εξαιρέσιμο ή μεταστατικό καρκίνωμα μαστού
(13/11/2020)
- Υποτροπιάζον ή μεταστατικό πλακώδες καρκίνωμα δέρματος που δεν επιδέχεται ίασης με χειρουργείο ή ακτινοθεραπεία
(24/06/2020)
- Προχωρημένο ή μεταστατικό καρκίνωμα ενδομητρίου
Σε ασθενείς που έχουν παρουσιάσει εξέλιξη νόσου μετά από μία προηγούμενη γραμμή χημειοθεραπείας, ανεξάρτητα από την έκφραση του PD-L1 στον όγκο, σε συνδυασμό με Lenvatinib
(17/09/2017)
- Μεταστατικό ή τοπικά προχωρημένο καρκίνωμα στομάχου ή γαστροοισοφαγικής συμβολής καρκίνωμα
Σε ασθενείς με αδενοκαρκίνωμα που όγκοι τους εκφράζουν PD-L1 (CPS) ≥1, με πρόοδο νόσου κατά τη διάρκεια ή μετά από 2 προηγούμενες γραμμές χημειοθεραπείας που περιέχουν 5-FU και πλατίνα ή/ και (εάν προβλέπεται) HER2/neu στοχεύουσα θεραπεία
(31/07/2019)
- Μεταστατικό ή τοπικά προχωρημένο καρκίνωμα οισοφάγου
Σε ασθενείς με πλακώδες καρκίνωμα που όγκοι τους εκφράζουν PD-L1 (CPS) ≥1, με πρόοδο νόσου μετά από 1 ή περισσότερες γραμμές χημειοθεραπείας
(31/07/2019)
- Μεταστατικό ή τοπικά προχωρημένο καρκίνωμα τραχήλου μήτρας
Σε ασθενείς που εμφανίζουν πρόοδο νόσου κατά τη διάρκεια ή μετά από 1ης γραμμής χημειοθεραπεία των οποίων οι όγκοι εκφράζουν PD-L1 (CPS) ≥1
(12/06/2018)
- Μεταστατικό ή τοπικά προχωρημένο ηπατοκυτταρικό καρκίνωμα
Σε ασθενείς που εμφανίζουν πρόοδο νόσου μετά από τη χορήγηση Sorafenib
(09/11/2018)
- Μεταστατικό ή τοπικά προχωρημένο Merkel Cell καρκίνωμα
Σε ασθενείς τοπικά προχωρημένο ή μεταστατικό Merkel Cell καρκίνωμα
(19/12/2018)
- Σε ασθενείς με όγκους που έχουν αυξημένο φορτίο μεταλλάξεων [≥10 mutations/megabase (mut/Mb)]
Σε ασθενείς που εμφανίζουν πρόοδο νόσου μετά από μία προηγούμενη γραμμή χημειοθεραπείας και δεν έχουν αποτελεσματική εναλλακτική θεραπευτική επιλογή
(17/06/2020)
- Σε ασθενείς με υψηλού κινδύνου μη μυο-διηθητικούς όγκους , με carcinoma in situ με ή χωρίς θηλώδεις όγκους, που δεν ανταποκρίνονται στη θεραπεία με BCG , που δεν επιθυμού ή δεν θέλουν να υποβληθούν σε κυστεκτομή
Σε ασθενείς που εμφανίζουν πρόοδο νόσου μετά από μία προηγούμενη γραμμή χημειοθεραπείας και δεν έχουν αποτελεσματική εναλλακτική θεραπευτική επιλογή
(08/01/2020)





